Schwarzknopf-Höckerschildkröte
Graptemys nigrinoda
Taxonomie:
Graptemys nigrinoda wurde zusammen mit Graptemys flavimaculata im Jahr 1954 von Fred Cagle beschrieben. Cagle benennt sie in Anspielung an die schwarzen knopfartigen Erhebungen am Rückenpanzer (lateinisch: nigrum = schwarz, nodum = Knopf) nigrinoda – die Schwarzgeknöpfte (Böhm 2012).
Zwei Unterarten sind beziehungsweise waren anerkannt. Die nördliche Form Graptemys nigrinoda nigrinoda und eine weit südlich verbreitete Unterart, Graptemys nigrinoda delticola, welche erst 1969 von Folkerts und Mount beschrieben wurde.
2014 stellte ein Team von Wissenschaftlern (Ennen et al.) den Unterartenstatus der delticola infrage. Bei den beiden Unterarten ist die erste Problematik die riesige Intergradationszone, welche viel größer ist als das Herkunftsgebiet der beiden puren Formen, d. h. Graptemys nigrinoda delticola ist nur sehr kleinflächig im Süden verbreitet und Graptemys nigrinoda nigrinoda hat sich in den weit nördlich befindlichen Flüssen ausgebreitet. Dazwischen sind demnach die Mehrzahl der Schildkröten als nigrinoda nigrinoda x nigrinoda delticola einzuordnen. Dieses Schema ist für eine Unterartenbildung nicht normal. Im Norden sind die Flüsse klar, schnellfliesend und kühler als im Süden. Dadurch erscheint diese Art dort eher kleiner, mit flacherem Carapax und mehr Gelbanteil. Nach Süden werden die Flüsse immer langsamer fliesend, wärmer und trüber. Demzufolge sind die dort lebenden Schildkröten erstens größer mit höherem Carapax und zweitens mehr und mehr dunkler gezeichnet. Es ergibt sich also ein langsamer Übergang. Zudem konnten bei den beiden Unterarten auch keine genetischen Unterschiede mittels mitochondrialer DNS-Sequenzierung bewiesen werden; was eigentlich auch logisch ist, schließlich wird das Verbreitungsgebiet der beiden Formen durch keine räumliche Barriere unterteilt, die einem Genfluss entgegenwirken könnte. Unter diesem Ergebnis, dass klare molekulare Unterschiede fehlen und die morphologisch festgestellten Differenzen klar mit den Flusscharakteristika einhergehen, plädieren die Autoren dafür, G. n. delticola nicht als distinkte Unterart anzusehen. Wahrscheinlich wird sich die Ansicht in Zukunft durchsetzen, da die Erfassung der delticola bereits 1970 von Freeman kritisiert wurde.
Taxonomische und evolutionäre Geschichte der Sawbacks:
Der Name „Sawback“ erscheint erstmals 1952 in Archie F. Carrs Handbook of Turtles. Cagle (1954) verwendet diesen Namen für die hier beschriebene Black-knobbed Sawback (Graptemys nigrinoda), die Yellow-blotched Sawback (Graptemys flavimaculata) und die Ringed Sawback (Graptemys oculifera).
Graptemys oculifera und Graptemys flavimaculata sind sehr eng miteinander verwandt und unterscheiden sich genetisch so gut wie gar nicht voneinander. Vom Körperbau unterscheiden sie sich ebenfalls nicht. Nur wegen ihrer unterschiedlichen farblichen Pigmentierung werden sie weiterhin als getrennte Arten angesehen (Ennen et al. 2010).
Graptemys nigrinoda ist von den anderen beiden Arten durch ihr äußeres Erscheinungsbild etwas abzugrenzen. Durch diese Tatsache und durch die Verwendung des einheitlichen Namens „Map Turtle” geriet der Name „Sawback” in den letzten Jahrzehnten leicht in Vergessenheit. Wie durch molekularen Analysen festgestellt wurde (Wiens et al. 2010), sind nicht nur G. oculifera und G. flavimaculata Schwesternarten, sondern G. nigrinoda ist ebenfalls eine Schwesternart von G. flavimaculata. Diese drei Arten bilden laut der Studie eine monophyletische Gruppe innerhalb der Gattung Graptemys. Sämtliche Autoren sind zwischenzeitlich wieder für die Verwendung und Beibehaltung des Namen Sawback, den ich persönlich auch einfach stark finde.
Die Entstehung der Sawbacks geschah vor ungefähr drei Millionen Jahren während geologischer Ereignisse in den Eiszeiten des Pleistozäns (Lamb et al. 1994). Falls die Sawbacks wirklich eine einheitliche Gruppe bilden und ihre Abstammung auf die Vorfahren ouachitensis und pseudogeographica aus dem Mississippi-Fluss zurückgeht, was laut Peter Lindeman (2013) hypothetisch der Fall ist, muss die Ausbreitung zu einem Zeitpunkt geschehen sein, als das Tennessee-Flusssystem mit dem Mobile River Becken verbunden war. Aus den Vorfahren von Graptemys nigrinoda sind daraufhin möglicherweise westwärts zum Pascagoula und Pearl River die anderen beiden Sawbacks abgedriftet. So könnten schlussendlich die beiden Schwesternarten flavimaculata und oculifera entstanden sein. Auch dafür hat Lindeman zwei Hypothesen: Entweder es geschah, als deren Nebenflüsse mal verbunden waren, oder es ereignete sich durch Meeresspiegelschwankungen und eine Verbindung der beiden Flüsse im Mündungsgebiet. Die Flussmündungen des Pascagoula und Pearl Rivers liegen schließlich nur 60 bzw. 105 Kilometer westlich der Mobile Bay.
Beschreibung:
Graptemys nigrinoda gehört zu den kleinen schmalköpfigen Graptemys-Arten.
Weibchen erreichen eine Rückenpanzerlänge von 15 bis 22 cm, die Männchen erreichen 7 bis 12 cm und werden oft weniger als halb so groß.
Der Rückenpanzer (Carapax) ist grünlich-olive bis braun und am hinteren Rand auffallend gezahnt. Die ersten vier Wirbelschilder (Vertebralschild) tragen diese einzigartigen „schwarzen Knöpfe”, die bei dem zweiten und dritten Wirbelschild und bei Jungtieren und Männchen besonders auffallend sind. Bei adulten Weibchen erscheinen sie nur noch klein und rundlich. Diese Knöpfe sind auf den Vertebralschilden umgeben mit einer netzförmigen gelben Zeichnung. Jedes Rippenschild (Pleural) besitzt einen dünnen, fast kreisförmigen gelben Ring. Die Randschilde (Marginalschilde) sind gezeichnet mit gelben sichelförmigen Linien.
Der Bauchpanzer (Plastron) ist normalerweise gelblich, manchmal auch rötlich, mit schwarzen Streifen entlang der Schildnähte.
Die Haut ist grau bis bräunlich mit gelben Streifen. Die typische Kopfzeichnung für Graptemys nigrinoda nigrinoda besteht aus einem sichelförmigen Fleck hinter den Augen, dessen Enden rückwärts in Halsrichtung verlaufen. Zwei bis vier Halsstreifen berühren die untere Augenhöhle und entlang des Kinns befindet sich ein horizontaler Balken.
Die Männchen haben verlängerte Vorderkrallen, längere Schwänze und im Körperverhältnis sehr lange Hinterbeine.
Die Tiere ganz im Süden (delticola?) unterscheiden sich vor allem durch die dunkle Bauchpanzerzeichnung, besonders ausgedehnt entlang der Schildnähte. Die Haut ist dunkler, die Flecken hinter den Augen sind nicht sichelförmig und verlaufen nicht rückwärts in Richtung Hals (Ernst & Lovich 2009, Blankenship et al. 2008). Die Delta-Höckerschildkröte (delticola) sieht G. oculifera zum Verwechseln ähnlich.
Lebensraum und Verbreitung:
Graptemys nigrinoda ist verbreitet in den Flüssen des Mobile-Bay-River-Beckens im südwestlichem und zentralem Alabama. Dort bewohnen sie normalerweise die Flüsse unterhalb der „Fall-Linie“, das heißt, sie sind jenseits der Linie, wo die Flüsse aus den Bergregionen entspringen, zu finden (Hertwig 2001).
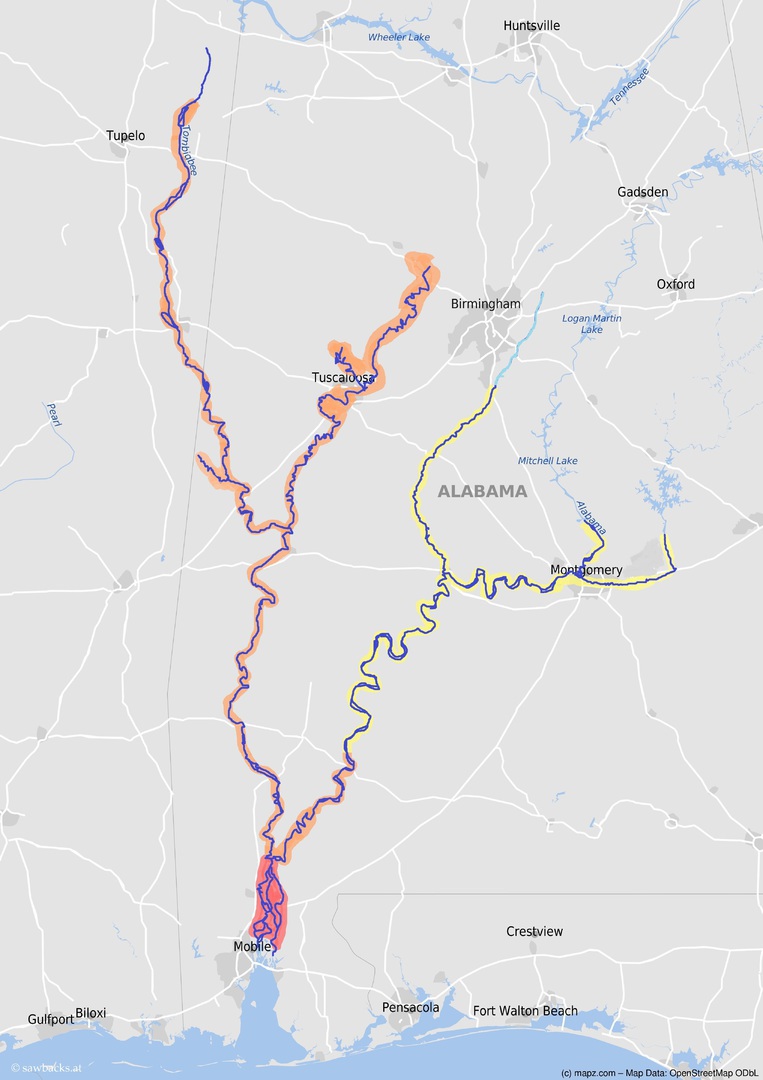
Graptemys nigrinoda kommt im Alabama, Cahaba, Black Warrior, Tallapoosa und im Coosa River vor, ebenfalls im Tombigbee River, der am Oberlauf im Bundesstaat Mississippi liegt (siehe Karte). Ganz im Süden bewohnen sie das Flussdelta der Mobile Bay sowie den Tensaw und Mobile River. Diese Flüsse mäandern sehr stark im gesamten Verlauf, so gibt es unterschiedliche Längenangaben. Insgesamt dürfte das bewohnte Flussgebiet bei über 2000 Kilometern liegen, es ist deshalb mehr als drei- oder fast viermal so groß wie das der anderen beiden Sawbacks. Die Flussbreiten variieren zwischen ca. 30 und 300 Metern und die Wassertiefe liegt zwischen 1 Meter und 12 Metern. Bis auf den Cahaba River werden alle Flüsse von zahlreichen Schleusen und Dämmen unterbrochen. Glücklicherweise ist diese Art dazu fähig, größere Stauseen zu nutzen, so kommt sie im Black Warrior River, Cahaba und im Coosa River auch oberhalb der Fall Linie vor (Blankenship et al. 2008, Lindeman 2013).
Im Norden bewohnt Graptemys nigrinoda schnell fliesende und schmale Ströme. Der Lebensraum im Süden besteht aus den breiten, träge dahinfliesenden Flüssen des Mobilen Delta. Die mit Altwasserarmen assoziierten Gewässer bilden ein großes aquatisches Labyrinth. Die Uferbereiche sind bewachsen mit Sumpfzypressen und Tupelobäumen. Das dadurch entstehende trübseichte sumpfähnliche Gebiet wird vor allem von Jungtieren gerne genutzt, während sich adulte Schildkröten eher in der Flussmitte aufhalten (Lahanas 1982, in Blankenship et al. 2008, Lindeman 2013). In den dazwischen liegenden Flüssen mit mäßiger Strömung, in denen der Grund aus Kies und Sand besteht, durch die Strömung in den inneren Biegungen der Flussschlingen viele Sandbänke entlang der Ufer entstehen, sich zahlreiche Bäume und Äste im Wasser befinden sowie zugleich wenig Bootsverkehr und menschliche Aktivität stattfindet, tummeln sich die meisten Graptemys nigrinoda. Flussabschnitte mit Felsvorsprüngen und aus Kalkstein bestehende Ufer besitzen weniger Totholz, weniger Sandbänke und auch weniger Schildkröten, ebenso kanalisierte oder für den Schiffsverkehr nutzbar gemachte Gebiete (Blankenship et al. 2008, Lindeman 2013).
Eine weitere Graptemys kommt im gleichen Lebensraum vor. Es handelt sich um die breitköpfige Schmuck-Höckerschildkröte (Graptemys pulchra), die auch viele Gebiete oberhalb der Fall Linie bewohnt, aber insgesamt deutlich geringere Populationsdichten aufweist.
Verbreitungsgebiet des Graptemys nigrinoda-Komplex nach Ennen et al. 2014 & Lindeman 2013.
rot – G. n. delticola, orange – G. nigrinoda x delticola, gelb – G. n. nigrinoda
Lebensweise:
Graptemys nigrinoda ist von Anfang April bis Ende November aktiv, wenn die Wassertemperaturen bei über 10° C liegen. Sonnenverhalten ist sehr ausgeprägt, wenn die Wassertemperaturen mehr als 15° C erreichen und bei sonnigen Tagen mit Lufttemperaturen über 20° C. Entscheidend ist auch die wetterbedingte Lichtintensität eines Tages. Wenn die Helligkeit unterhalb von 50.000 Lux liegt, ist nur wenig Sonnenverhalten zu beobachten, während sie bei über 85.000 Lux richtig aktiv werden und sich sehr oft sonnen (Waters 1974, in Ernst & Lovich 2009). Dabei bevorzugen sie Sonnenplätze, die vom Wasser umgeben sind. Wenn bei höherem Wasserlevel die anderen Sonnenplätze überflutet sind, wird auch das Ufer zum Sonnen genutzt. Ansonsten verlassen nur die Weibchen die Flüsse, um Eier zu legen (Blankenship et al. 2008, Ernst & Lovich 2009).
Diese Tiere sind sehr standorttreu und sonnen sich oft Tag für Tag an denselben Plätzen. Zum Schlafen verkauern sie sich unter die gleichen Äste und Baumstämme und verbringen dort schutzsuchend die Nacht. Jungtiere nutzen zum Sonnen gerne Äste in Ufernähe, die im Durchmesser zwischen 1,5 und 6 cm liegen. Männliche und subadulte Weibchen wählen Äste mit 5 bis 12,5 cm Durchmesser und geschlechtsreife Weibchen nutzen Äste und Baumstämme, die 7 bis 20 cm dick sind (Ernst & Lovich 2009). Der Carapax ist bei Männchen oft mit Algen bewachsen, besonders im Frühjahr und nach einem langen Winter (Lindeman 2013).
Wachstum:
Im Flussdelta des Alabama und Tombigbee Flusses wächst diese Art im gesamten Jahresverlauf nur 170 bis 180 Tage. Vor April beginnt die Nahrungsaufnahme für gewöhnlich nicht, doch im Mai tritt bereits ein richtiger Wachstumsschub auf. In den restlichen Monaten bis zum September wachsen sie dann wesentlich langsamer, gefressen wird aber noch bis November (Lahanas 1982, zit. in Lindeman 2013 und Ernst & Lovich 2009). Männliche Graptemys nigrinoda wachsen im ersten Jahr auf durchschnittliche 51 mm, im zweiten Jahr auf 66 mm, im dritten Jahr auf 73 mm, und im vierten Jahr auf 81 mm.
Weibchen wachsen schneller und erreichen im ersten Jahr oft schon 58 mm, im zweiten 77 mm, im dritten Jahr 101 mm, im vierten Jahr 116 mm, im fünften Jahr 130 mm, im sechsten Jahr 141 mm, im siebten Jahr 158 mm, im achten Jahr 165 mm und mit neun Jahren 178 mm (Lahanas 1982, in Ernst & Lovich 2009). Das sind allerdings Werte von Graptemys nigrinoda delticola, im Norden werden die Tiere nicht so groß und wachsen eventuell langsamer.
Fortpflanzung:
Von den südlich lebenden G. nigrinoda ist seit der Masterarbeit von Lahanas (1982) am Tensaw River einiges über das Reproduktionsverhalten bekannt. Sofern nicht anders angegeben, stammen folgende Informationen daraus (zitiert in Ernst & Lovich 2009). Über die weiter nördlich vorkommenden Schildkröten ist bisher nicht viel zur Fortpflanzung bekannt geworden.
Die Geschlechtsreife tritt bei männlichen Graptemys nigrinoda ab einer Plastronlänge von 7 cm und im Alter von 3 bis 4 Jahren ein, bei den Weibchen dagegen erst mit 8 bis 9 Jahren. Graptemys nigrinoda zeigt, wenn man es genau betrachtet, ein sehr interessantes Balzverhalten, das mir erst genau auffiel, nachdem ich es im Turtles of the United States and Canada gelesen hatte. Die Männchen halten dabei ihre Nase an die Nase eines Weibchens und beginnen, ruckartig mit dem Kopf vertikal zu „wackeln“ (nicken). In einer Sekunde bewegen sie ihren Kopf dreimal auf und ab, dann erfolgt eine kurze Pause von zwei Sekunden, bis sie anfangen, erneut zu nicken. Genau dieses Verhalten sieht man tatsächlich relativ oft bei männlichen G. nigrinoda, bei den Weibchen hin und wieder. Gelegentlich ist bei den Männchen auch ein Zittern mit den Vorderbeinen zu beobachten. Das Kopfnicken steht aber immer im Vordergrund.
Bei Graptemys nigrinoda ist der Reproduktionszyklus kein ständiger Prozess, sondern zieht sich Schritt für Schritt über das ganze Jahr hindurch, mit einer Unterbrechung während der Wintermonate.
Bei den Männchen unterscheidet sich die Spermienproduktion (Spermatogenese) nicht wesentlich von der des Menschen, aber dies dauert nicht wie beim Mann nur 65 Tage, sondern mehrere Monate und findet nur einmal im Jahr statt. Die Spermatogenese beginnt demgemäß erst im Juni und ist im Herbst beendet. In den Monaten April bis Juni sind die Samenkanälchen verkleinert, aber Spermatogonien und Sertoli-Zellen befinden sich entlang der Basalmembran und die Nebenhoden sind voll mit reifen Spermien. Im Juni erweitern sich die Samenkanälchen und die Spermatogenese beginnt, bis sie im August ihren Höhepunkt erreicht. Spermatide und die Vorläuferzellen davon (Spermatogonien und Spermatozyten) sind dann ausgiebig vorhanden. Im August beginnt die Spermiogenese, d. h., die Spermatiden reifen zu Spermien und wandern zum Tubuluslumen. Die Nebenhoden sind zu dieser Zeit leer und zusammengeschrumpft. Das letzte Reifestadium erreicht im September den Höhepunkt und die Testis (Hoden) erlangen ihre maximale Größe. Ebenso steigt der Durchmesser der Samenkanälchen, deren Lumen nun komplett mit reifen Samenzellen gefüllt wird. Im Oktober ist die Spermiogenese schließlich beendet und die ausgebildeten Spermien werden in die sich rapide ausdehnenden Nebenhoden verlagert. Im November ist auch dieser Vorgang abgeschlossen. Die Samenkanälchen ziehen sich wieder zusammen und die Lumen sind leer. Manche Spermien sind noch in den Testis, aber die Nebenhoden sind vollgepackt mit reifen Spermien und werden dort bis zum Frühjahr gespeichert. Insgesamt bedeutet das, dass nur in den Monaten Oktober bis November sowie im Frühling und zu Anfang des Sommers Paarungen stattfinden können. Das erklärt auch das allgemeine Desinteresse der Männchen an den Weibchen während der Sommermonate, wobei Shealy (1976, zit. in Lindeman 2013) bei einer anderen Graptemys-Art (G. ernsti) Spermien von April bis Dezember in den Nebenhoden feststellen konnte.
Der Reproduktionszyklus bei den Weibchen beginnt mit der Vitellogenese, bereits kurz nach dem Absetzen des letzten Geleges eines Jahres, also im August oder September. Die Vitellogenese ist die Synthese von Lipiden und Proteinen in der Leber und deren Einlagerung in die Follikel als Dotter (Hertwig 2001). Lahanas unterteilte die Follikel in vier verschiedene Größenklassen. Klasse 1 (kleiner als 5 mm) und Klasse 2 (5 bis 10 mm) sind im September und Oktober vorhanden und in dieser Größenordnung sonst zu keiner anderen Jahreszeit. Größenklasse 3 (11 bis 16 mm) konnte Lahanas erstmals im Oktober und November finden. Während der Wintermonate und der unterbrechenden Nahrungsaufnahme erfolgt bei den Follikeln natürlich eine Wachstumspause. Nach der Überwinterung entwickeln sich die Eier im März und April weiter und erlangen einen Monat vor Beginn der Legesaison Follikel-Größenklasse 4, die im Dotterumfang etwa gleichgroß wie beschalte Eier sind. Wenige Tage vor dem Absetzen des Geleges erfolgen die Ovulation (Eisprung) und der Aufbau der Eischale. In diesem engen Zeitraum müssen die Eier natürlich noch vor der Bildung der Eischale befruchtet werden. Da in diesen wenigen Tagen kaum Paarungen stattfinden, verfügen die Weibchen über die Möglichkeit der Speicherung aktiver Spermien in den Ovidukten. Die Weibchen können die Samenzellen so lange speichern, dass es zumindest für die Befruchtungen aller Eier eines Jahres ausreicht (Hertwig 2001), eventuell auch für längere Zeit.
Lahanas beschreibt das Nistverhalten von G. nigrinoda-Weibchen auf der Insel Gravine, die sich inmitten des Tensaw Rivers befindet. Die Nistsasion begann dort Ende Mai und endete Anfang August. Von Mitte Juni bis Mitte Juli legten die meisten Weibchen und insgesamt dauerte es ca. 72 Tage. Die Weibchen nisteten dort immer nach Einbruch der Dunkelheit, hauptsächlich im Zeitraum zwischen 21 Uhr und Mitternacht. Zirka eine Stunde, bevor es dunkel wurde, begannen die Weibchen, nach einem geeigneten Nistplatz zu suchen. Sobald sie sich an Land befanden, waren sie sehr vorsichtig und beim kleinsten Anzeichen von Gefahr kehrten sie zurück zum Wasser. Bevor die Eier vergraben werden, müssen die Weibchen zunächst eine Stelle finden, wo sich die Eier auch gut entwickeln können. Dazu unternehmen sie mehrere Probegrabungen, indem sie mit den Vorderbeinen im Sand wühlen und ihr Kinn in den Sand drücken oder darin schnüffeln. Im Englischen wird dieses Verhalten mit „ground-nuzzling“ bezeichnet. Es ist nicht sicher, ob sie dabei Gerüche oder die Temperatur des Substrates testen, eventuell auch beides. Die Kopfregion ist jedenfalls sehr feinfühlend bezüglich der Temperatur und die Weibchen vergraben ihre Eier an zu kühlen Plätzen nur ungern oder gar nicht (Meier 1997). Im August maß Lahanas eine mittlere Temperatur von 30°C in den natürlichen Nestern. Manche Weibchen wenden nicht mehr als ein paar Minuten für die Auswahl des Nistplatzes auf, aber bei anderen kann es sich über mehrere Versuche hinziehen und eine Stunde oder noch länger dauern. Manche Weibchen werfen mit ihren Vorderbeinen Sand über ihren Rückenpanzer, möglicherweise als Tarnung oder als Schutz vor Überhitzung. Sobald sie eine geeignete Stelle zum Nisten gefunden haben, nehmen die Weibchen eine schräge Körperposition ein, in der die vordere Region des Panzers erhöht ist. Dafür nutzen sie zufällige Unebenheiten, Grasbüschel oder sie schieben wie ein Bulldozer etwas Sand vor sich hin, damit sie dann darauf diese Kippstellung einnehmen können. Das erleichtert die Aushebung der Eigrube, in der sie abwechselnde Schaufelbewegungen mit den Hinterbeinen ausführen. Das Anlegen der Nistgrube dauerte 16 bis 34 Minuten. Es ist erstaunlich, dass es die Weibchen schaffen, birnenförmige Höhlen auszugraben, die bei den von Lahanas untersuchten Nestern insgesamt ca. 15 cm tief waren und im unteren Bereich einen Durchmesser von ungefähr 9 cm hatten. Die schmalere flaschenhalsförmige Öffnung hatte nur einen Durchmesser von knappen 5 Zentimetern und eine Tiefe von fünfeinhalb Zentimeter bis zum eigentlichen kugelförmigen Hohlraum. Nach dem Ausheben der Nistgrube setzen die Weibchen ihre Eier im Intervall von ein bis zwei Minuten ab, indem sie gleichzeitig mit dem Kopf krampfartig nicken oder ihn in den Panzer einziehen. Sobald ein Ei in die Eihöhle fällt, positionieren sie es gleich darauf mit einem Hinterbein. Die Dauer der Eiablage ist abhängig von der Gelegegröße und dauert in der Regel 8 bis 10 Minuten. Nach der Eiablage verschließen die Weibchen die Eigrube mit abwechselnden Bewegungen der Hinterbeine, bis sie voll mit Sand ist, vorher kneten sie aber noch Sand in die Zwischenräume der Eier. Bevor sie zurück zum Wasser wandern, führen sie noch stampfende Bewegungen mit den Hinterbeinen aus, werfen mit den Vorderbeinen etwas Sand über das frisch geschlossene Nest oder rutschen mit dem Plastron darüber, um es zu tarnen. Das gesamte kräftezehrende und für die Weibchen äußerst anstrengende Nistverhalten dauerte 1 bis 3 Stunden. (Ein fast identisches Nistverhaltensmuster beschreibt Moore (2003) für G. flavimaculata und Lindeman (2013) für viele andere Höckerschildkrötenarten, mit dem Unterschied, dass die Weibchen anderer Spezies eher vormittags ihre Eier legen und G. flavimaculata am späten Nachmittag. Der gesamte hier beschriebene Reproduktionszyklus unterscheidet sich auch nicht wesentlich von anderen Graptemys-Arten, abgesehen von klimatisch bedingten zeitlich veränderten Differenzen).
Die meisten Nester lokalisierte Lahanas 2 bis 4 Meter über dem normalen Wasserspiegel und im Umkreis von 50 Meter zur Wasserlinie in sonnig exponierten feinsandigen Flächen. Lahanas vermutet, dass die Weibchen drei oder vier Gelege alljährlich ablegten. Ein einzelnes Gelege der Weibchen vom Tensaw River enthielt approximativ 5,6 (3 bis 7) Eier, während die Weibchen aus dem Alabama River nur eine Gelegegröße von 2 bis 5 Eiern erreichen (Lindeman 2013). Lahanas stellte bei 42 Eiern eine durchschnittliche Länge und Breite von 37,03 mm bzw. 23,78 mm fest.
Die kleinen Graptemys nigrinoda schlüpfen ab Ende August bis Ende Oktober nach ca. 63 Tagen im Nest und verbleiben noch weitere 8 bis 13 Tage dort, bis der Dottersack absorbiert ist. Scheinbar wissen die Kleinen, nachdem sie sich ausgegraben haben, nicht instinktiv, wo sich das Wasser befindet. Lahanas beobachtete 25 Schlüpflinge in insgesamt 10 Nestern, nur 4 wanderten nach Norden zum nahegelegenen Wasser. 6 gingen nach Osten, 8 nach Westen und 7 wanderten nach Süden, in entgegengesetzter Richtung zum Wasser. Dennoch fanden sie innerhalb von 24 Stunden den Fluss. Die frisch geschlüpften Baby-nigrinoda weisen eine Carapaxlänge von 36,5 mm auf, die Carapaxbreite ist mit 36,7 mm sogar größer. Ihre auffallenden Knöpfe am Rückenpanzer sind im Schlüpflingsalter nicht so knopfartig wie bei adulten Männchen, es finden sich eher lateral ansteigende Spitzen, die im Körperverhältnis zweimal so groß sind wie bei Männchen und viermal so groß wie bei adulten Weibchen.
Nesträuber sind überwiegend Fischkrähen. 82 Prozent der Nester, die Lahanas observierte, wurden von diesen Beutegreifern zerstört. Gürteltiere, Waschbären und eingeschleppte Rote Feierameisen sind weitere potenzielle Nestprädatoren. Schlüpflinge und juvenile Schildkröten könnten unter Umständen großen Fischen, Ochsenfröschen und Alligatoren zum Opfer fallen (Blankenship et al. 2008). Lahanas berichtet außerdem von mehreren adulten Männchen mit anhaltenden Panzerverletzungen, die möglicherweise von Alligatoren stammten.
Ernährung:
Als schmalköpfige Graptemys grasen sie gerne mit ihrem Hornschneiden an festsitzender Nahrung wie Algen oder Süßwasserschwämmen und Moostierchen (Bryozoen). Weitere Nahrung besteht aus folgenden Tieren: Flusskrebse, Krabben, Kelchwürmer, Spinnen, Schnecken, einheimische Muscheln sowie kleine Fische. Auch eingeschleppte asiatische Muscheln stehen als Nahrung zu Verfügung. Graptemys nigrinoda verzehrt auch viele Insekten, beispielsweise Eintagsfliegen, Klein- und Großlibellen, Käfer, Ameisen, Schmetterlinge, Ruderwanzen, Wasserflöhe und Faltenwespen (Ernst & Lovich 2009, Lindeman 2013). Wahlquist (1970) beobachtete mehrmals, wie diese Art nach ins Wasser gefallen Insekten Ausschau hielt. Wenn sie ein Insekt an der Wasseroberfläche erblickt hatten, tauchten sie schnell auf und fraßen es gleich darauf.
Lahanas (zit. in Blankenship et al. 2008) untersuchte Darminhalte von 15 Männchen und 17 Weibchen aus dem Tensaw River. Die Männchen enthielten 58.3 % an tierischer Nahrung und 40.4 % an pflanzlichen Stoffen. Bei den Weibchen bestand das Nahrungsvolumen zu 69,2 % aus tierischen und zu 28.1 % aus pflanzlichen Substanzen. Das meiste, was an tierischer Nahrung konsumiert wurde, waren Süßwasserschwämme, Bryozoen und Mollusken. Grünalgen konnten als die einzigen Pflanzarten nachgewiesen werden. Nördlich ansässige Männchen zeigen im Gegensatz zu denen aus südlichen Regionen eine größere Kieferbreite und sind deshalb möglicherweise mehr auf Schnecken spezialisiert (Ennen et al. 2014).
Populationen:
Graptemys nigrinoda geht es gut und im Vergleich zu den anderen Graptemys-Arten entlang der Golfküste geht es ihnen sogar am besten (Buhlmann et al. 2008). In dem großen Verbreitungsgebiet und den verbundenen Flüssen können diese Schildkröten kanalisierte Stellen meiden und starkem Schiffsverkehrsaufkommen ausweichen. Peter Lindeman hält G. nigrinoda für die vierthäufigste Graptemys-Art, basierend auf extensiven Beobachtungen aller Höckerschildkröten (van Dijk 2013). Durchschnittlich 15 bis 23 Graptemys nigrinoda konnten in unterschiedlichen Untersuchungen pro Flusskilometer beim Sonnen beobachtet werden. Verglichen mit der sympatrisch lebenden Graptemys pulchra, bei der nur 2,3 Schildköten per Flusskilometer gezählt wurden, ist das sehr viel (Review in Blankenship et al. 2008). Die besten Populationen existieren laut Godwin (2001, in Lindeman 2013) im Black Warrior River, in dem 93 % von allen beobachteten Schildkröten G. nigrinoda waren, gefolgt vom Tensaw River mit 92 %. Im Tombigbee und Alabama River übertraf G. nigrinoda mit 88 % bzw. 82 % alle andere Schildkrötenarten beim Sonnen. Im Cahaba River dominierten sie mit 81 % und im Tallapoosa River mit 45 %. Lediglich im Coosa River konnten mehr G. pulchra als G. nigrinoda gezählt werden (57 % vs. 22 %), das ist der einzige Fluss in dem G. nigrinoda (nur) die zweithäufigste Schildkrötenspezies ist.
Bedrohung und Schutzstatus:
Graptemys nigrinoda wird bedroht durch Lebensraumzerstörung und direkte und indirekte Verfolgung durch Menschen. Die Entfernung von Baumstämmen, Verbauungen von Niststränden oder Störung der Weibchen durch Erholungssuchende und Camper, (die auch unabsichtlich Nester zerstören) beeinträchtigt diese Schildkröten am meisten im Fortbestehen. Absammlungen für den Tierhandel, intensiver Konsum von Schildkröteneiern für Nahrungszwecke sowie mutwilliges Sportschießen auf Schildkröten in jüngster Vergangenheit dürften die Populationsgrößen erheblich dezimiert haben. Die invasive Feuerameise, die man in vielen Nestern von G. nigrinoda und P. alabamensis fand, könnte langzeitliche negative Konsequenzen im Populationstrend mit sich bringen. Adulte Schildkröten ertrinken in Stellnetzen oder Fischreusen. Fischer töten gelegentlich auch Schildkröten, wenn sie als Beifang in Fischleinennetzen enden, darüber hinaus wird von Panzerverletzungen durch Bootspropeller berichtet (Ernst & Lovich 2009, Buhlmann et al. 2008, Blankenship et al. 2008, van Dijk 2013).
Graptemys nigrinoda gilt als „Endangered“ (gefährdet) in Mississippi und als „Protected Nongame Species” (als selten betrachtet, aber nicht geschützt) im Bundesstaat Alabama (Blankenship et al. 2008, Böhm 2012).
Auf den stabilen Populationen beruht die gegenwärtige Einstufung in der IUCN Roten Liste als “Least concern“ (nicht bedroht), erst 2011 wurden sie von „Near threatened“ abgestuft. Wie alle Graptemys-Arten sind sie effektiv seit dem 14. Juni 2006 im Anhang III des Washingtoner Artenschutzübereinkommens gelistet.
Graptemys nigrinoda bewohnt einige Schutzgebiete, die zwar nicht speziell für sie eingerichtet wurden und auch nicht direkt die Flüsse schützen, aber dennoch einen positiven Nutzen bewirken. Eines der größten Schutzgebiete befindet sich im Mobile-Tensaw Delta. Alabama schützt in diesem Segment 37.850 Hektar Land, aufgeteilt auf zwei Naturschutzgebiete. Kleinere geschützte Landstriche befinden sich entlang des Alabama Rivers, des Cahaba, Coosa, Tallapoosa und des Tombigbee Rivers (Blankenship et al. 2008, Lindeman 2013). Nützlich für G. nigrinoda erweisen sich auch die Schutzmaßnahmen der sehr gefährdeten Alabama-Rotbauch-Schmuckschildkröte (Pseudemys alabamensis), bei der man sogar schon Schlüpflinge 16 Monate lang in Menschenobhut aufgezogen und anschließend ausgewildert hat (Nelson et al. 2009). Graptemys nigrinoda profitiert von allen Habitat-Erhaltungsprojekten, die für Pseudemys alabamensis realisiert werden (Blankenship et al. 2008).
Inzwischen besteht ein strenges Fangverbot. Bei einer verdeckten Ermittlung in Wilcox County in Alabama konnten sogenannte Schildkrötenfänger aufgegriffen werden. Von diesen wurde für jede gefangene Graptemys nigrinoda eine Geldstrafe von 500 Dollar gefordert (Lindeman 2013).
Graptemys nigrinoda in Menschenhand:
Graptemys nigrinoda ist unter den Sawbacks die am meisten in Menschenhand gehaltene Art, wobei fast alle Tiere zur nördlichen Form zählen. Die Delta-Höckerschildkröte (Graptemys n. delticola) wird unter Züchterkreisen in Europa nach wie vor als Unterart angesehen, aber nur sehr selten gehalten und nachgezogen, deshalb sind sie sehr schwierig zu bekommen.
Die Schwarzknopf-Höckerschildkröte ist die ideale Anfängerschildkröte, gut zu halten und auch ganz gut von einigen Züchtern zu bekommen. Diese Schildkröten verbringen oft Stunden damit, quer, auf und ab durchs Becken zu schwimmen. Tagsüber Sonnen sie sich oft bis zu zwanzigmal und es wird immer wieder begeistert nach Futter gesucht - es ist einfach eine Freude, diese lebensfrohen Tiere zu halten, und es ist mehrfach bewiesen, dass sich diese Schildkröten auch in Gefangenschaftshaltung gut entwickeln. Auch die Zucht scheint gut zu klappen. Ein gesundes und gut gehaltenes Weibchen kann jährlich ohne weiteres 15 oder sogar bis zu 25 befruchtete Eier legen, aus denen robuste kleine Schildkröten schlüpfen (E. Roddewig, pers. Mitt.).
Was mir immer wieder auffällt, ist, dass Graptemys nigrinoda sehr gerne Pflanzliches frisst, bereits im Frühjahr bei noch kälteren Wassertemperaturen. Besonders beliebt sind Wasserlinsen und andere Schwimmpflanzen. Ansonsten ist die Haltung ähnlich wie bei den meisten Graptemys Arten.
Literatur:
Blankenship, E. L., B. P. Butterfield & J. C. Godwin (2008). Graptemys nigrinoda Cagle 1954 – Black-knobbed map turtle, Black-knobbed sawback. In A. G. J. Rhodin, P. C. H. Pritchard, P. P. van Dijk, R. A. Saumure, K. A. Buhlman & J. B. Iverson (Eds.). Conservation Biology of Freshwater Turtles and Tortoises: A Compilation Projekt of the IUCN/SSC Tortoise and Freshwater Turtle Specialist Group. Chelonian Research Mono-graphs No. 5.
Böhm, S. (2012). Höckerschildkröten – die Gattung Graptemys Agassiz, 1857 im Portrait. Sacalia 10 (35): 22–55.
Buhlmann, K., T. Tuberville & W. Gibbons (2008). Turtles of the Southeast. The University of Georgia Press, Athens, Georgia.
Cagle F. R. (1954). Two new species of the genus Graptemys. Tulane Studies in Zoology 1:167–186.
Ennen, J. R., M. E. Kalis, A. L. Patterson, B. R. Kreiser, J. E. Lovich, J. Godwin & C. P. Qualls (2014). Clinal variation or validation of a subspecies? A case study of the Graptemys nigrinoda complex (Testudines: Emydidae). Biological Journal of the Linnean Society 111(4): 810–822.
Ennen, J. R., B. R. Kreiser, C. P. Qualls & J. E. Lovich (2010). Morphological and molecular reassessment of Graptemys oculifera and Graptemys flavimaculata (Testudines: Emydidae). Journal of Herpetology, 44(4), 544–554.
Ernst, C. H. & J. E. Lovich (2009). Turtles of the United States and Canada. Second Edition. The Johns Hopkins University Press, Baltimore, Maryland.
Folkerts, G. W. & R. H. Mount (1969). A new subspecies of the turtle Graptemys nigrinoda. Copeia, 1969, 677–682.
Freeman, H. L. (1970). A comment on: A new species of the turtle Graptemys nigrinoda Cagle. Herpetological Review, 2, 3.
Hertwig, S. (2001). Ökologie, Haltung und Fortpflanzung im Terrarium von Graptemys caglei, G. flavimaculata, G. nigrinoda nigrinoda und G. oculifera. Salamandra, 37(1), 21–48.
Lamb, T., C. Lydeard, R. B. Walker & J. W. Gibbons (1994). Molecular systematics of map turtles (Graptemys): a comparison of mitochondrial restriction site versus sequence data. Systematic Biology 43: 543–559.
Lindeman, P. V. (2013). The Map Turtle and Sawback Atlas: Ecology, Evolution, Distribution, and Conservation. University of Oklahoma Press, Norman.
Meier, E. (1997). Eiablageprobleme bei Schildkröten – ein meist hausgemachtes Problem. Reptilia, 2(4), 62–64.
Moore, M. J. C. (2003). Behavioral ecology of the threatened yellow-blotched map turtle, (Graptemys flavimaculata): implications for conservation and management. Master’s thesis, Southeastern Louisiana University, Hammond, LA.
Nelson, D. H., G. J. Langford, J. A. Borden & W. M. Turner (2009). Reproductive and hatchling ecology of the Alabama red-bellied cooter (Pseudemys alabamensis): Implications for conservation and management. Chelonian Conservation & Biology, 8(1), 66–73.
Roddewig, E. (2010). Meine Erfahrungen bei der Haltung und Zucht der Schwarzknopf-Höckerschildkröte, Graptemys nigrinoda nigrinoda Cagle, 1954. Radiata, 19(4), 2–18.
Stettner, A. (2005). Haltung und Nachzucht von Graptemys nigrinoda nigrinoda der Schwarzknopf-Höckerschildkröte. Sacalia Stiefern, 3 (6): 9–20.
van Dijk, P. P. (2013). Graptemys nigrinoda. The IUCN Red List of Threatened Species. Version 2014.3. <www.iucnredlist.org>. Abgerufen am 28. März 2015.
Die meisten Höckerschildkröten sind sehr scheu. Eine absolute Ausnahme ist eins meiner Männchen, da er regelmäßig zum Betteln an Land kommt. Gerade solche Tiere können einem sehr ans Herz wachsen.