Gelbflecken-Höckerschildkröte
Graptemys flavimaculata
Taxonomie:
August 1952: Fred Cagle, Professor der Tulane University, und seine
Studenten, hatten schon aus einigen Flusssystemen der USA verschiedene, teilweise noch unbeschriebene, Arten von Höckerschildkröten gefangen. Graptemys oculifera aus dem Pearl River war
bereits viele Jahre bekannt und im Black Warrior River in Alabama fingen sie am 7. August die ersten Exemplare der später bekannten Graptemys nigrinoda. In ersten Forschungseinträgen
bezeichnete Cagle diese Schildkröten als „Graptemys nebulus“ und darauffolgend als „nodulosus“.
Aufgrund der überraschenden Höckerschildkrötenartenvielfalt der einzelnen Flusssysteme fragte er sich: „What Graptemys are found in the Pascagoula River? Does nodulosus intergrade with oculifera in this section?“ Am 17. August fingen sie schließlich die ersten Exemplare jener Art, die später als die weltweit schönste Wasserschildkröte bekannt wird. Dies waren allerdings nicht die ersten bekannten Museumsexemplare, da schon 1930 eines aus dem Pascagoula River gefangen wurde, welches als G. pseudogeographica kohnii angesehen wurde (Review in Lindeman 2013).
1954 verfasste Cagle die Erstbeschreibung und benannte die Art anhand ihrer gelben Fleckenzeichnung (Lateinisch: flavus = gelb, maculatus = gefleckt) als Graptemys flavimaculata.
Graptemys flavimaculata und Graptemys oculifera sind eindeutig sehr nah verwandte Arten, die häufig auch als Schwesterntaxa bezeichnet werden. Diese Tatsache ist angesichts mehrerer phylogenetischer Studien, die sich insbesondere auf mitochondriale DNA-Sequenzdaten stützen, unumstritten (Lamb et al. 1994, Lamb & Osentoski 1997, Stephens & Wiens 2003, Wiens et al. 2010 und Ennen et al. 2010). Das muss man sich so vorstellen, dass sich gewisse Abschnitte der mitochondrialen DNA-Stränge bei beiden Arten kaum, d. h. nur durch wenige Basenpaare, unterscheiden. In einer nuklearen DNA-Sequenzierung konnten Wiens et al. (2010) zwar auch nur eine geringe, aber dennoch größere Differenzierung zwischen G. flavimaculata und G. oculifera feststellen. Dabei geht G. flavimaculata auch als Schwesternart von G. nigrinoda hervor. Da sich das Erscheinungsbild bei G. oculifera und G. flavimaculata manchmal überschneidet, untersuchten Ennen et al. (2010) mittels multivariater Statistik einige Museumscharaktere auf morphologische Unterschiede. Sie kamen zum Resultat, dass neben den unterschiedlichen Zeichnungen auf den Pleuralschilden, G. flavimaculata im Allgemeinen eine gelblichere Pigmentierung als Graptemys oculifera am Carapax und auf den Weichteilen aufweist. Außerdem fanden sie auch differenzierte Merkmale bei den Kopfzeichnungen. Deshalb und infolge der Ergebnisse von Wiens et al. (2010), plädieren die Wissenschaftler für eine weitere valide Anerkennung der beiden Arten. G. oculifera und G. flavimaculata bilden auch in zwei mitochondrialen Genen eine Verwandtschaft zu G. sabinensis (Lamb & Osentoski 1997).
Beschreibung:
Graptemys flavimaculata zählt zu den kleinen schmalköpfigen Höckerschildkrötenarten. Männchen erreichen eine maximale Carapaxlänge von 11,9 cm und werden bis zu 250g schwer. Weibchen erlangen dagegen bis zu 21,4 cm und 1675g. Die Weibchen werden somit meist mehr als doppelt so groß wie die kleinen Männchen und sieben oder sogar zehnmal so schwer (Jones 1996, Selman & Jones 2011).
Der Carapax weißt bei Männchen und Jungtieren auf den ersten, zweiten und dritten Wirbelschilden seitlich ansteigende Spitzen auf, die bei adulten Weibchen wesentlich kleiner erscheinen. Bei den Männchen sind die Vorderkrallen deutlich verlängert. Auf jedem Randschild befindet sich ein gelber bis gelboranger halbkreisförmiger oder gerader Balken. Die charakteristischen Flecken auf den 4 Pleuralschilden sind immer ungleichförmig oder unterbrochen bis hin zu halbmondförmig. Selten können auch komplette Ringe vorhanden sein. Auf der hellschwarzen Haut befinden sich gelbe bis grüngelbe Streifen. Hinter jedem Auge befindet sich ein Fleck, der kreisförmig, dreieckig bis rechteckig variabel sein kann und zwischen den Augen verläuft ein Streifen bis zur Nasenspitze. Ausgehend vom Orbit ziehen sich zwei dicke Wangenstreifen in Richtung Hals (Cagle 1954, Selman & Jones 2011).
Lebensraum und Verbreitung:
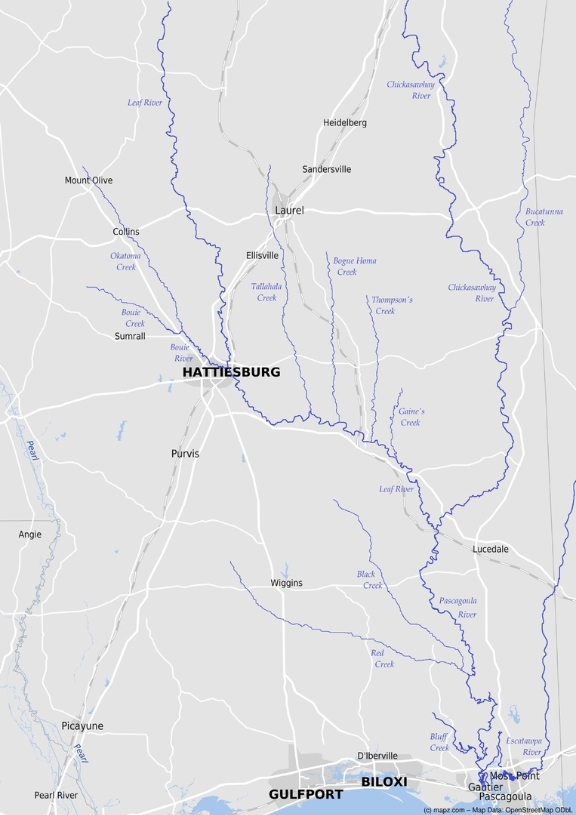
Graptemys flavimaculata bewohnt das Pascagoula Flussbecken im südlichen Mississippi. Dieses Einzugsgebiet ist das unberührteste große Flusssystem der Vereinigten Staaten, welches in seiner natürlichen Dynamik bisher kaum verändert wurde. G. flavimaculata und G. gibbonsi sind die einzigen der vierzehn Graptemys-Arten, die bislang nicht in der Umgebung von größeren Staudämmen leben (Lindeman 2013). Leider wird dies nicht so bleiben, denn direkt am Pascagoula River ist ein Reservoir geplant, welches „Lake George“ heißen soll. Trotzdem ist der Pascagoula River mit seinen Zuflüssen ein Naturparadies für mehr als 320 Tierarten und wird von den meisten Landsleuten Mississippis als solches sehr geschätzt. Indianerlegenden zufolge wird er auch als „The Singing River“ bezeichnet.
Die größten Bestände von G. flavimaculata leben im Pascagoula River, der mit einer Länge von 130 km und einer Breite von 50 bis 150 Metern den Hauptstrom bildet. Innerhalb dieser Flussaue befinden sich jede Menge von angrenzenden Altwasserseen und Bayous, das sind langsam fließende oder stehende Gewässer. Flussabwärts existiert G. flavimaculata bis 13,5 km vor der Mündung in den Golf, obwohl auch schon einige Exemplare in Küstennähe gesichtet wurden. Diese scheinen dort aber nicht lebensfähig zu sein und sind wahrscheinlich während Überflutungen aus dem Pascagoula River geschwemmt worden (Selman 2012, Selman & Qualls 2009, Selman & Jones 2011).
Die beiden großen Zuflüsse, Leaf und Chickasawhay River, werden ebenfalls von G. flavimaculata bewohnt. Der Leaf River ist ein 290 Kilometer langer Fluss und 20 bis 50 Meter breit (Selman 2012). Das Wasser ist in den Sommermonaten teilweise so seicht, dass keine großen Boote mehr passieren können (Selman & Qualls 2011). Sowohl der Pascagoula als auch der Leaf River bieten für G. flavimaculata den geeignetsten Lebensraum. Zirka 24 km nördlich der Mündung, in der Nähe von Vancleave, bis stromaufwärts zur Stadt Hattiesburg leben die größten G. flavimaculata Populationen. Die beiden Flüsse mäandern sehr stark, bieten genug Sonnenplätze sowie anliegende flache Sandbänke und sind so breit, dass im Tagesverlauf genügend Sonneneinstrahlung zur Verfügung steht. Der Grund besteht meist aus Kies und Sand. Die Uferzonen sind dicht bewachsen mit amerikanischen Eichen, Birken, Fichten, Kiefern und Ahornbäumen sowie Sumpfzypressen und Schwarz-Weiden (Selman & Qualls 2009, Selman 2012).
Der Chickasawhay River ist mit 340 Kilometern der längste Fluss im Einzugsgebiet. In der Regel weist er eine Größe von 30 bis 90 Metern auf. Im Chickasawhay River leben im Vergleich zu den beiden anderen Flüssen weniger Schildkröten. Möglicherweise liegt der Grund darin, dass er weniger Flussschlingen besitzt und daher eine stärkere Strömung aufweist. Überdies ist er eher schattig, hat weniger Sandbänke und mehr felsigen Untergrund (Selman 2012, Selman & Qualls 2009). Die Mehrheit von G. flavimaculata lebt aufgeteilt in diesen drei großen Flüssen, was eine gesamte Flussverbreitungslänge von 567 Kilometern ergibt: Pascagoula 99 km, Leaf 219 km und Chickasawhay 249 km (Selman & Jones 2011). G. flavimaculata hat von den drei Sawbacks-Arten das kleinste Verbreitungsgebiet.
G. flavimaculata kommt aber auch im Unterlauf von Bächen und kleineren Zuflüssen vor: Bouie River, Black- und Red Creek, Tallahala-, Bogue Homa-, Bouie-, Gaines-, Bucatunna-, Thompson- und Okatoma Creeks. Somit kommen sie sowohl in jedem kleineren Nebenfluss als auch in größeren Bächen im gesamten Stromgebiet vor. Diese weisen dann eine Breite von 15 bis 20 Metern auf und erfüllen die gleichen Eigenschaften wie der Pascagoula und Leaf River, nur eben im kleineren Format. In manchen davon hatte man sie erst zwischen 2005 und 2008 entdeckt, als Will Selman und seine Kollegen jeden noch so kleinen Bach auf Graptemys hin untersuchten. Graptemys flavimaculata bewohnt weder zu schmale Bäche noch ausgebaggerte Flussläufe. Gleiches gilt für Bereiche inmitten von städtischen Abwässern oder Abwasseraufbereitungsanlagen in der näheren Umgebung von Hattiesburg, in denen darüber hinaus auch sämtliches Totholz entfernt wurde (Selman & Jones 2011).
Es gibt zwei kleine Populationen in Mündungsnähe, die isoliert von der Hauptpopulation leben, und zwar im Escatawpa River und im Bluff Creek. Diese sind durch ein Sumpfgebiet vom Pascagoula River getrennt. Im Escatawpa River dürfte diesem Umstand ein geologisches Ereignis zu Grunde liegen, das möglicherweise bereits vor 11.500 Jahren geschehen ist (Selman et al. 2013b). Die Wissenschaftler begründen dies damit, dass sich die G. flavimaculata aus dem Escatawpa River genetisch am meisten von den anderen distanzieren. Außerdem weisen diese Sawbacks eine komplette Ringzeichnung auf den Pleuralschilden auf. Man könnte sie mit Graptemys oculifera verwechseln, wenn man deren Herkunft nicht kennt (Selman & Jones 2011).
Innerhalb dieser Flüsse treffen sie auf folgende andere Schildkrötenarten: Graptemys gibbonsi, Pseudemys concinna, Trachemys scripta elegans, Sternotherus carinatus, Sternotherus oduratus, Macrochelys temminckii, Apalone mutica und Apalone spinifera (Lovich et al. 2009).
Lebensweise:
Graptemys flavimaculata ist seit vielen Jahren eine streng geschützte Art. Das macht sie für Erforschungen natürlich interessant, dementsprechend viele Studien gibt es auch über sie. Nach der Jahrtausendwende hat sich Will Selman eingehend dieser Art gewidmet und seitdem großartige und sehr detailgenaue Studien über Graptemys flavimaculata veröffentlicht. Außerdem hat er seine Dissertation darüber geschrieben: Conservation and Ecology oft the Yellow-blotched Sawback, die im Mai 2010 erschienen ist. Sämtliche Publikationen sind auf seiner Webseite, www.willselman.com, unter Pulblications frei zugänglich.
Aktionsbereich und saisonale Bewegungsabläufe:
Eine der interessantesten Studien über G. flavimaculata stammt von Jones 1996. Er bestimmte mit der Telemetrie-Methodik, welchen variablen und jahreszeitlichen Lebensraum Graptemys flavimaculata nutzt. Dafür fing er 1992 und 1993 16 Männchen sowie 10 Weibchen und stattete diese mit einem Transponder aus.
Erforscht hatte er die Schildkröten am Pascagoula River in Mündungsnähe, in der Ward Bayou WMA (Wildlife Management Area), siehe Google Earth Karte (nicht in der mobilen Ansicht verfügbar).
Dort teilt sich der Fluss in den East- und West Pascagoula River. Die Flussbreite oberhalb der Teilung liegt bei 100 bis 120 Metern und das Wasser ist teilweise mehr als 12 Meter tief. Auf der Karte sind auch einige Seitenarme und der Parish Lake, welcher die Form eines „Hufeisens“ hat, zu sehen (Wenn man auf der Karte etwas zoomt, werden die Orte auch angezeigt). Der Parish Lake ist ca. 70 Meter breit und bis zu 3,5 Meter tief.
Das alljährliche Bewegungsmuster bei Graptemys flavimaculata ist abhängig von der Wassertemperatur, Strömungsgeschwindigkeit und vom Reproduktionszyklus. Sowohl Männchen als auch Weibchen nutzen je nach Jahreszeit eine Vielzahl an unterschiedlichen Lebensräumen und kehren immer wieder zu ausgewählten Standorten zurück.
Der Aktionsraum für sechs Männchen lag bei 0,29 bis 2,02 (Mittelwert 1,12) Hektar und einer durchschnittlichen Bewegungslänge von 1,8 km (180 bis 5.904 Meter). Sieben Weibchen nutzten einen mittleren Bewegungsradius von 5,75 Hektar (0,34 bis 13,84 ha) und eine mittlere Aktionslänge von 1,5 Kilometern (226 bis 2.850 Meter).
Während der Periode von Juni bis Oktober, als die Strömung am geringsten war, zeigten sich die Schildkröten relativ standorttreu und hielten sich im Uferbereich von 50 bis 200 Metern auf. Ein Weibchen beispielweise nutzte zwei Jahre lang eine Uferlänge von 130 Metern und verließ diesen Bereich alljährlich nur dreimal. Die meisten Schildkröten verbrachten ihre Zeit an einer Flussuferseite, häufig im äußeren Bereich der Flussschlingen, wo das Wasser durch die Erosion tiefer ist und durch die stärkere Strömung mehr Treibholz dorthin verlagert wird; mit dem geringen Unterschied, dass das Auftreten der Männchen mit seichteren Uferbereichen, langsamer Strömung und mit viel Treibholz assoziiert war, welches ihnen Schutz und etwas zum Festklammern bietet. Aufgehalten hatten sich die männlichen Schildkröten 4,4 bis 6,4 Meter vom Ufer entfernt. Die Weibchen hielten sich aufgrund ihrer Größe und ihrer besseren Schwimmfähigkeit einige Meter (1,7 – 10,7m) weiter entfernt vom Ufer im tieferen Wasser auf. Dort fließt das Wasser schneller und existieren weniger ins Wasser gefallene Bäume. In schmäleren Flusskanälen wechselten sie auch die Uferseiten.
Während der Nistperiode sind die Weibchen am aktivsten und schwimmen einerseits oft weitere Strecken zu Sandbänken, verbringen das restliche Jahr aber andererseits in Altwasserseen. Die Männchen schwammen in den niederschlagreichsten Monaten, von November bis Mai, weitere Strecken, um Überflutungen aus dem Weg zu gehen und suchten – auch aufgrund der tiefen Wassertemperaturen, die natürlich ihre Agilität einschränkt – Stellen mit geringer Strömung auf.
Die Geschichte von einzelnen Schildkröten:
Der Transponder scheint die Schildkröten im Verhalten nicht beeinträchtigt zu haben, obwohl eines der Männchen aus unerklärlichen Gründen einen Monat nach der Befestigung des Transponders verstarb. Eines der Weibchen wurde während der Studie durch eine Bootsschraube getötet.
Ein Weibchen verbrachte ihre Aktivität, mit Ausnahme zur Nistzeit, ausschließlich im Parish Lake. Jones fing sie das erste Mal im Pascagoula River im Juni 1992, an der Stelle, die dem See am nächsten liegt. Dort verblieb sie bis Anfang August. Dann wanderte sie über den kleinen Landstreifen, ca. 100 Meter, zum Parish Lake. Dies wiederholte sie in den darauf folgenden zwei Jahren. Am 27. Mai 1993 und am 25. Mai 1994 kehrte sie wieder zum Pascagoula River zurück und dort hielt sie sich durchwegs in der Nähe einer Sandbank auf. Jeweils am 29. Juni 1993 und am 19. Juli 1994 ging sie wieder zurück zum Parish Lake. Ein weiteres Weibchen verbrachte den Sommer 1993 an einer Flussbiegung am Westufer des Pascagoula Rivers, gegenüber einer großen Sandbank auf der Ostseite. Nur dreimal wurde ihre Position auf der Ostseite im flachen Wasser an der Sandbank bestimmt, am 16. Juni sowie am 7. und 27. Juli.
Innerhalb von wenigen Tagen und mehreren Wochen verließen im späten Oktober und Anfang November drei Männchen und vier Weibchen ihre Sommerhabitate und schwammen Distanzen von 0,5 bis über 5 Kilometer. Ein Männchen begab sich durch einen kleinen Bach in einen ca. 1 Kilometer entfernten Altwassersee. Ein zweites bewegte sich von einer Flussbiegung im Außenbereich zirka 500 Meter flussabwärts hinter die Flusskrümmung. Ein drittes Männchen hatte die größten Strecken zurückgelegt. Das erste Mal gefangen wurde es am 17. September 1992 im Pascagoula River in der Umgebung des Parish Lakes. Dort verbrachte es noch ungefähr einen weiteren Monat. Dann bewegte es sich innerhalb von vier Tagen, zwischen 6. und 10. November, etwa 5 Kilometer stromabwärts in den West Pascagoula River. In der Gegend von Ward Bayou verblieb es bis 9. Februar 1993. Von da aus hatte sich das Männchen dann wieder flussaufwärts begeben. Am 4. März war es wieder im Gebiet am Pascagoula River, wo es zum ersten Mal eingefangen wurde, dann aber bewegte es sich erneut flussabwärts. Am 2. April befand es sich in einem schmalen Seitenarm in Parish Lake Bayou. Da verblieb es bis Ende April. Dann endete die Batterielaufzeit des Transponders. Anschließend muss es aber erneut flussaufwärts geschwommen sein. Am 29. Juni 1993 fing Jones das Männchen an dem Ast und in derselben Sonnenfalle, in der er es neun Monate zuvor auch eingefangen hatte. Alle drei Männchen wurden nie an Land lokalisiert, allerdings begaben sie sich während eines höheren Wasserpegels ins Landesinnere, meist in überschwemmte Auwälder.
Zwei Weibchen durchquerten keine großen Bewegungsdistanzen. Eines davon wurde am Westufer des Pascagoula Rivers gefangen und schwamm Mitte Oktober 1,5 Kilometer flussabwärts nach Ward Bayou. Im späten März wurde sie dort das letzte Mal lokalisiert, als ihr Transponder versagte. Das andere Weibchen, welches im September 1992 auch im Pascagoula River in einer Flussbiegung eingefangen wurde, schwamm Ende Oktober lediglich 0,5 km aufwärts zu einer geraden Sektion des Flusses. Im April des darauf folgenden Jahres kehrte sie wieder zu ihrem Sommeraktionsraum zurück.
Zwei weitere Weibchen zeigten ein komplexeres Bewegungsmuster. Sie hielten sich im September 1992 gerade in einer der steilen Flussbiegungen im Pascagoula River auf. Im späten Oktober schwammen sie 1,5 Kilometer flussaufwärts und begaben sich über Land in einen 100 Meter vom Fluss entfernten Zypressenteich, der weniger als 2 Meter tief war und eine Oberfläche von 4,5 Hektar aufwies. Offenbar wechselten die Weibchen während des höheren Pegelstandes in den Wintermonaten manchmal zwischen dem Fluss und diesem Teich. Am 10. März beobachtete Jones eines der Weibchen, wie Sie gerade 20 Meter entfernt vom Fluss in Richtung des Teiches wanderte, den sie später im Tagesverlauf erreichte. Beide Weibchen blieben bis Mitte Mai im Teich, bis sie wieder zum Fluss zurückkehrten und dort den ganzen Sommer 1993 verbrachten. Beide Weibchen wiederholten ihr Bewegungsmuster im Herbst wieder, denn im Frühling darauf, am 17. März 1994, hatte Jones die beiden wieder im Teich vorgefunden. Anfang Mai verließen sie wiederum den Teich und anschließend hielten sie sich auch den Sommer 1994 über am Westufer des Pascagoula Rivers auf.
Die erhöhte Aktivität der Männchen im Oktober dürfte auf den Beginn der Paarungszeit zurückzuführen sein. Dadurch, dass aber auch manche Weibchen im Herbst ihren Standort wechseln, wird es auch mit dem bevorstehenden Winter und den fallenden Wassertemperaturen im Zusammenhang stehen. Jones sah mehrere G. flavimaculata Weibchen Ende des Winters und im zeitigen Frühling im erwähnten Zypressenteich. Die Weibchen, die in den Zypressenteich abgewandert sind, dürften sich die höheren Wassertemperaturen in diesem Stillgewässer zunutze gemacht haben. Im späten März lagen die Wassertemperaturen im Fluss noch bei etwa 15° C. Im anliegenden seichten Teich dürften sie allerdings höher gewesen sein, was den Weibchen eine vorzeitige Nahrungsaufnahme erlaubt hatte. Im Sommer wucherte dieser Teich dann stark mit Wasserpflanzen zu. Dies bietet den Graptemys keinen günstigen Lebensraum mehr (Diskussion in Jones 1996).
Die Studie von Jones beweist deutlich, dass diese Schildkröten nicht planlos durch die Gegend schwimmen, sondern durchaus einen ausgeprägten Orientierungssinn besitzen. Das wiederholte Aufsuchen eines bestimmten Lebensraumes ist bemerkenswert und zeigt einmal mehr, dass die oft erwähnte „Dummheit“, die Schildkröten immer wieder zugeschrieben wird, absolut nicht zutrifft. Obwohl G. flavimaculata mehrmals im Jahr ihren Standort wechselt und innerhalb weniger Tage weite Strecken zurücklegen kann, zeigen sie doch eine gewisse Standorttreue, wenn das ausgewählte Habitat ihre Präferenzen erfüllt.
Sonnenökologie:
Graptemys flavimaculata verbringt das ganze Jahr über – auch an warmen Wintertagen – viel Zeit damit, sich zu sonnen. Oft stapeln sich diese Tiere übereinander auf Baumstämmen und klettern dabei mehrere Meter über die Wasserlinie. Diese Art sonnt sich bereits kurz nach Sonnenaufgang bis nach Sonnenuntergang bei Regenwetter, aufziehenden Gewitterstürmen und sogar bei Außentemperaturen von unter 16° C (Moore 2003, Selman & Qualls 2011).
Selman & Qualls (2011) erforschten ihr saisonales Sonnenverhalten in den Monaten Juni bis Oktober 2007 und April bis Mai 2008 am Leaf River, in Forrest County. Graptemys flavimaculata lebt dort nach wie vor relativ ungestört, was Vorrausetzung für diese Studie war, da sie in stark frequentierten Flussbereichen kaum noch ihr natürliches Verhalten zeigt.
Die beiden Forscher machten Aufzeichnungen darüber, wie lange und wie oft sich diese Schildkröten zu welcher Tages- und Jahreszeit sonnten und welches „Deadwood“ sie bevorzugt als Sonnenplatz wählten. Zudem maßen sie auch die Wasser-, Tages- und Sonnenplatztemperaturen.
Die durchschnittliche Besonnungsdauer über das ganze Jahr lag für beide Geschlechter und Jungtiere bei 38,4 Minuten. Männchen sonnten sich im Mittelwert 36,2 Minuten, Weibchen 42,8 und Jungtiere 23,5 Minuten. Von insgesamt 1.124 beobachteten Schildkröten sonnten sich 120 Tiere länger als 100 Minuten. 17 Exemplare sonnten sich länger als 200 Minuten und nur 5 länger als 300 Minuten. Das längste durchgehende Sonnenverhalten mit 7 Stunden und 44 Minuten wurde am 15. April 2008 bei einem Männchen beobachtet. Die Sonnenplatztemperaturen reichten von 27,3 bis 33,2° C und waren wesentlich wärmer als die Wasser- (16,4 – 20° C) und Lufttemperaturen (13° – 17,6° C). Ein Weibchen sonnte sich maximal 5 Stunden und 36 Minuten.
Es ist nicht verwunderlich, dass sich die Weibchen aufgrund ihrer Masse meistens länger als die Männchen und Jungtiere sonnen. Da die Unterschiede bei Männchen und Weibchen aber nicht so gravierend sind - im Vergleich zu ihrem Geschlechtsdimorphismus - gehen die beiden Autoren davon aus, dass die Männchen infolge ihrer geringen Größe und Agilität ihre Körpertemperatur besser regulieren können, indem sie öfter ihre Position wechseln und damit verbunden eine Überhitzung verhindern können.
Juvenile Graptemys flavimaculata wurden hauptsächlich in Ufernähe auf Baumstämmen und Ästen mit überhängender Vegetation beobachtet, gewiss um ihrem Schutzbedürfnis nachzukommen. Weibchen sonnen sich fast nur auf Baumstämmen und schwimmenden Baumstümpfen, selten jedoch auf Ästen. Männchen nutzen Baumstämme, Äste sowie auch Baumkronen.
Im Frühling bei noch tieferen Wassertemperaturen sonnen sich beide Geschlechter am häufigsten, vor allem zur Mittagszeit (12 – 14 Uhr) und für längere Zeiten in den Morgenstunden. Im Sommer konnten Peaks um 9 Uhr morgens und zwischen 16 und 19 Uhr abends beobachtet werden. Im Herbst ist es ähnlich wie im Frühjahr, mit Peaks zwischen 12 und 16 Uhr. Die Weibchen sonnen sich im Herbst seltener als im Frühjahr. Die Männchen sonnen sich über das ganze Jahr etwa gleich oder sogar häufiger als die Weibchen und durchwegs oft im Oktober bis November. Dies könnte mit dem Spermien-Bildungszyklus zusammenhängen (Moore 2003).
Speziell bei der Studie von Selman & Qualls (2011) sonnten sich die Graptemys ungewöhnlich oft im Juli. Das dürfte aber auf einen sehr kühlen und verregneten Monat zurückzuführen sein und ist sicher ungewöhnlich für diese Jahreszeit. Die Wassertemperaturen erreichten in den Sommermonaten trotzdem knappe 35° C. Für die Körpertemperaturregelung wäre das Sonnen somit eigentlich nicht mehr notwendig. Dennoch sonnt sich Graptemys flavimaculata auch bei derartig hohen Wassertemperaturen. Zum einen wahrscheinlich, um weiterhin Vitamin D bilden zu können und zum anderen wechseln viele Schildkröten in den Sommermonaten ihre Schilde und stoßen diese dabei ab, wie Selman (2010) und Selman & Qualls (2011) annehmen.
Die gemessenen Temperaturen ergaben für April bis Oktober folgende Werte: Wassertemperaturen: 15 bis 34,7° C; Außentemperaturen: 10,9 bis 39,8° C und die Sonnenplatztemperaturen ergaben Werte von 10,6 bis 42,5° C. Selman & Qualls bestimmten auch die optimalen Umgebungstemperaturen, die von Graptemys flavimaculata vorzugsweise zum Sonnen genutzt wurden. Diese belaufen sich bei Wassertemperaturen auf 16 bis 31° C, bei Außentemperaturen auf 15 bis 35° C und bei Temperaturen auf den Baumstämmen auf 23 bis 40° C.
Während der Wintermonate liegen die Wassertemperaturen bei ca. 10 bis 15° C. Diese können im Herbst überraschend schnell abfallen und im Frühling wiederum rasch ansteigen. Moore (2003) konnte im Dezember eine nur sehr geringe Sonnenaktivität bei G. flavimaculata feststellen (0,03 gezählte Schildkröten im Vergleichszeitraum eines Jahres) und selbst im März nur vereinzelt Schildkröten beim Sonnen beobachten. Im Jänner und Februar war eine Untersuchung aufgrund heftiger Überflutungen nicht möglich.
Leider gibt es bisher keine Angaben bezüglich der Frage, wie oft sich eine einzelne Graptemys flavimaculata am Tag sonnt. Selman (2010) berichtet von drei Ausnahmen, weil er diese Tiere an ihrer unverwechselbaren Carapaxzeichnung unterscheiden konnte und über längere Zeit beobachtete.
-
Am 20. Juni 2007 sonnte sich ein Weibchen zwischen 13:43 und 15:11 Uhr achtmal auf demselben Baumstamm mit einer gesamten Besonnungsdauer von 74 Minuten, aber sehr kurzen Intervallzeiten (17, 13, 10, 8, 5, 7, 8 und 6 min.). Es existieren keine Angaben zu den Temperaturen, trotzdem sollte man die hohe Sonnenfrequenz während der knappen eineinhalb Stunden beachten.
-
Am 10. September 2007 wechselte ein juveniles Weibchen 8 Mal zwischen unterschiedlichen Ästen und Zweigen im Zeitraum von 8:57 (Wt.: 26,9° C, At.: 26,6° C & Spt.: 28° C) bis 14:00 (Wt.: 29,4° C, At.: 32,2° C, Spt.: 33,6°C) und sonnte sich insgesamt 163 Minuten mit Intervallzeiten von 80, 9, 52, 19, 8, 8, 29, 31 Minuten. Dieses Weibchen wurde zweimal von einer anderen Schildkröte vom Sonnenplatz gestoßen. Man beachte hierbei die Unterschiede der Wassertemperaturen innerhalb der 5 Stunden.
-
Ein Männchen sonnte sich am 8. April 9 Mal zwischen 9:39 Vormittags (Wt.: 20,1° C, At.: 19° C, Spt.: 19° C) und 13:05 Mittags (Wt.: 24,4° C, At.: 26,2° C, Spt.: 32,4° C). Das Männchen wechselte immer zwischen einem Baumstamm sowie einem schwimmenden Treibholz und erreichte eine gesamte Besonnungszeit von 147 Minuten (3, 2, 17, 9, 39, 2, 1, 2 und 72 Minuten). Auffallend sind die noch größeren Unterschiede bei den Wassertemperaturen innerhalb dieser 3 Stunden und 26 Minuten.
Da bei diesen Angaben die Schildkröten auch nur wenige Stunden beobachtet wurden, kann man davon ausgehen, dass sie normalerweise weitaus öfter als zehnmal am Tag den Sonnenplatz aufsuchen.
Selman (2011) beobachtete G. flavimaculata, die manchmal ihren Kopf unter Wasser hielten, bevor sie vom Sonnenplatz ins Wasser zurückkehrten. Möglicherweise tun sie das um die Wassertemperatur zu prüfen. Er geht davon aus, dass ihre Kopfregion mehr Temperaturrezeptoren besitzt als die restliche Körperregion und sie deswegen äußerst feinfühlend auf Temperaturen reagiert. Das erklärt auch, warum Weibchen beim Nisten ihr Kinn ins Substrat drücken und dabei eventuell die Temperatur prüfen, bevor sie die Eigrube anlegen (Moore 2003, Selman 2011).
Am Leaf River werden diese Schildkröten nur selten von Menschen beim Sonnen, aber durchaus von anderen Tieren, verschreckt. Man denke zum Beispiel an Vögel und Biber. Oftmals werden sie von anderen Schildkröten gestört. Wenn diese auf den Sonnenplatz klettern oder ein Exemplar vom Sonnenplatz flieht, löst das eine Kettereaktion aus und alle sich sonnenden Schildkröten springen ins Wasser. Kleinere Exemplare werden manchmal von größeren Schildkröten vom Sonnenplatz gestoßen. Vor allem die Weibchen zeigen keine Skrupel vor kleineren Schildkröten, wenn sie ihren gewünschten Sonnenplatz erreichen wollen. So konnten Selman und Qualls (2008a) beobachten, wie sich ein Graptemys flavimaculata Weibchen unterhalb einer kleineren Apalone mutica auf einem Ast sonnte. Ihr Panzer befand sich noch zur Hälfte im Wasser. Kurz darauf streckte die G. flavimaculata eines ihrer Vorderbeine aus, schubste die A. mutica vom Ast und nahm unmittelbar danach deren Platz ein. Anders sieht es allerdings mit der Konkurrenz von größeren Schildkröten aus. Dieselben Autoren konnten mehrere G. flavimaculata Weibchen dabei beobachten, wie sie auf einen Ast klettern wollten. Sie schwammen darum herum und streckten ihre Köpfe aus dem Wasser. Jedoch wurde der Ast gleich zu Beginn von einer großen Pseudemys concinna blockiert. Zwei der Weibchen kletterten schlussendlich von der anderen Seite auf den Ast, der aber von dort aus wesentlich steiler aus dem Wasser ragte.
Im Allgemeinen ist es bei Graptemys wahrscheinlich, dass sie sich während des Sonnenverhaltens auch in gewisser Weise ausruhen. Schließlich müssen sie wegen der Strömung ununterbrochen im Wasser schwimmen, sofern sie nicht irgendwo Halt finden. Das zeigt wiederum einen wesentlichen Unterschied zu Wasserschildkröten, die Stillgewässer bewohnen.
Wachstum:
Im ersten Jahr besitzen Jungtiere etwa eine gleiche Carapaxlänge und -breite von 44 mm und wiegen 15 Gramm (Jones & Selman 2011). In den ersten 5 Jahren wachsen wildlebende Männchen und Weibchen ziemlich schnell heran. Sind die Weibchen gleich groß wie die adulten Männchen, ist abgesehen von der Schwanzgröße schon zu erkennen, dass die Weibchen einen größeren Kopf und einen voluminöseren Carapax bekommen. Männchen erlangen für gewöhnlich in den ersten fünf Jahren eine Plastronlänge von 80 mm, während der Plastron der Weibchen dann bereits eine Länge von 95 mm erreichen kann (Jones 1994, in Selman & Jones 2011).
Graptemys flavimaculata wird innerhalb der Flussdrainage unterschiedlich groß. Selman (2012) vermaß insgesamt 456 Individuen aus dem Pascagoula, Leaf und Chickasawhay River. Dabei stellte sich heraus, dass die Weibchen und Männchen aus dem Pascagoula River signifikant größer und schwerer werden als jene vom Leaf und Chickasawhay River. Außerdem weisen die Weibchen im Pascagoula River deutlich breitere Köpfe auf. Dies dürfte an ihrer speziellen Vorliebe für Mollusken liegen (Lindeman 2000).
|
|
Männchen Plastronlängen und Gewicht |
Weibchen Plastronlängen und Gewicht |
|
|
Pascagoula River: |
|||
|
Anzahl vermessener Tiere: |
132 |
88 |
|
|
|
Mittelwert: Min: Max: |
9cm; 145,5g 7,6cm; 80g 11,8cm; 220g |
15,9cm; 900,3g 9,8cm; 175g 18,9cm; 1550g |
|
Leaf River: |
|||
|
Anzahl vermessener Tiere: |
78 |
42 |
|
|
|
Mittelwert: Min: Max: |
8,5cm; 118,9g 5,8cm; 25g 10,9cm; 250g |
14,1cm; 591,5g 6,6cm; 60g 16,8cm; 950g |
|
Chickasawhay River: |
|||
|
Anzahl vermessener Tiere: |
58 |
49 |
|
|
|
Mittelwert: Min: Max: |
7,7cm; 88,5g 6,1cm; 45g 9,3cm; 210g |
13,2cm; 505,6g 6,5cm; 60g 17cm; 1050g |
|
|
|||
Die Differenzen in der Körpergröße könnten an der stabileren Temperatur des größeren Pascagoula Rivers, am besseren Nahrungsangebot, an der Abwesenheit eines Nahrungskonkurrenten, (da Graptemys gibbonsi im Pascagoula River nur gering vorkommt) oder an der unterschiedlichen Strömungsgeschwindigkeit der einzelnen Flüsse liegen (Diskussion in Selman 2012).
Ernährung:
Graptemys flavimaculata ernährt sich nicht spektakulär abwechslungsreich, sondern überwiegend von Schwämmen, Mollusken, Insekten und Algen. Andere Beutetiere sind bei Stichproben in bedeutungsloser Menge gefunden worden (Lindeman 2013). Aus Analysen von sezierten Museumstieren und Kotproben weiß man, dass aufwachsende Schwämme von beiden Geschlechtern und Jungtieren am häufigsten verzehrt werden. Des Weiteren nehmen Männchen hauptsächlich Algen, Insekten und Bryozoen-Kolonien zu sich, Weibchen ergänzen noch viele aquatische Insekten. Juvenile Schildkröten fressen mehr Insekten und Algen. Die Weibchen aus dem Pascagoula River konsumieren die gleiche Menge an nativen Muscheln wie Schwämmen, während in den weiter nördlich befindlichen Flüssen bei den Weibchen kein Muschelverzehr nachgewiesen werden konnte (Seigel & Brauman 1994, in Lindeman 2013).
Selman & Qualls (2008a) konnten zweimal jeweils ein Weibchen vom Boot aus beobachten, wie sie gerade bei submersen Ästen am Algenaufwuchs grasten. Dabei durchsuchten sie mit den Vorderbeinen den Algenrasen. Ob sie darin nach Mikrowirbellosen suchten oder einfach nur so die Algen fraßen, ist unklar. Jedenfalls konnten die Forscher später keine Evidenz von aquatischen Insekten auf den Ästen inspizieren.
In Sektionen fanden Steinauer & Horne (2002) bei Graptemys flavimaculata acht wirtspezifische Wurmparasiten, wovon mindestens drei durch Mollusken übertragen wurden. Allerdings hatte keiner davon eine schädliche Wirkung auf die Schildkröten ausgeübt.
Reproduktion:
Das Balzverhalten geschieht bei Graptemys flavimaculata Kopf an Kopf, während die Männchen mit der Innenseite ihrer Vorderbeine und ihren verlängerten Krallen die seitliche Kopfregion der Weibchen bezittern. Selman (in Selman & Jones 2011) beobachtete bei Aquariumstieren ein zusätzliches Kopfzittern/-nicken, wie es auch von G. nigrinoda bekannt ist. Bei meinen Männchen konnte ich allerdings nur ein Vibrieren mit den Vorderbeinen beobachten. Gleiches berichtet Hertwig (2001). Männchen werden im Alter von zwei bis drei Jahren geschlechtsreif (Jones 1993, in Lindeman 2013). Bei wildlebenden Weibchen ist noch nicht genau bekannt, mit welchem Alter sie ausgewachsen sind (Lindeman 2013). Jones (1993) geht von 8 bis 10 Jahren aus. Das kleinste geschlechtsreife Weibchen, welches Cagle (1954) dokumentierte, besaß eine Carapaxlänge von 14,9 cm.
Alle Fortpflanzungsstudien über G. flavimaculata stammen bisher aus demselben Flussgebiet, in dem auch Jones (1996) die Telemetrie-Studie durchführte (Shelby et al. 2000, Horne et al. 2003, Moore 2003, Moore & Seigel 2006). Die Testosteronwerte sind bei den Männchen im September und Oktober am höchsten und erlangen im April und Mai einen kleinen zusätzlichen Peak. Bei den Weibchen steigen die Östrogenwerte (E2) im Mai bis Juni, also zur Zeit der Eientwicklung (Shelby et al. 2000, Shelby & Mendonca 2001). Paarungen dürften während beziehungsweise nach den Wintermonaten stattfinden, obwohl Shelby et al. (2000) von einem Paarungsverhalten Ende Mai und Anfang Juni berichten. Trächtige Weibchen und Nester fand man während einer vierjährigen Untersuchungszeit (1993, 1994, 1996, 1997) vom 18. Mai bis zum 14. August. Die Nistsaison dauerte 80 bis 87 Tage (Horne et al. 2003). Weibchen nisten von 6 Uhr morgens bis 19:15 am Abend. In der Regel suchen sie einen Nistplatz, der durchschnittlich 8 (1,3 – 17,1) Meter von der Wasserlinie entfernt liegt. 48 Prozent der Weibchen, die Moore (2003) beobachtete, legten ausschließlich zwischen 15 und 17 Uhr. Ungewöhnlich war, dass sie häufig an verregneten Tagen nisteten. Offenbar liegt dies an Nestprädatoren, allem voran Fischkrähen, die bei schlechtem Wetter nicht sonderlich aktiv sind. Moore (2003) errechnete bei ihren Beobachtungen eine gesamte Eiablagezeit von nur 22 bis 60 Minuten (durchschnittlich 34,6 Minuten). Das ist für Emydide außergewöhnlich schnell. Möglicherweise haben die Weibchen gelernt, die Eiablage zu beschleunigen, um dem großen Bootsverkehr, den vielen Campern, Picknickern und Prädatoren aus dem Weg zu gehen. Sobald ein Weibchen eine Sandbank betreten hatte, gab es eine Chance von nur 19 %, dass sie die Eiablage auch erfolgreich beenden konnte, bevor sie von Menschen dabei gestört wurde. Oft warteten die Weibchen mehrere Stunden, bis sie sich auf eine Sandbank begaben, auch dann, wenn sie unbehindert waren. An Tagen, an denen viele Erholungssuchende anwesend waren, überwachten die Weibchen 4 bis 6 Stunden die Sandbänke, nisteten aber schlussendlich nicht (Moore & Seigel 2006). Scheinbar wählen aus demselben Grund manche Weibchen einen ungewöhnlichen Nistplatz und vergraben ihre Eier an vegetationsreichen, stark beschatteten Steilufern, in lehmigem Bodengrund. Horne und Moore (in Horne et al. 2003) beobachteten, wie manche Weibchen an solchen Bereichen versuchten zu nisten. Teilweise waren die Ufer, an denen sie hochkletterten, steiler als 65 Grad. Die dort ermittelte Durchschnittstemperatur im Substrat war mit 25,9° C geringer als bei den Sandbänken (28,7° C) und somit unterhalb des für G. flavimaculata bekannten Schwellenwertes in der Geschlechtsdetermination, der bei 29 bis 29,5° C liegt (Hertwig 2001, Lindeman 2013).
Freigelegte Nester hatten eine approximative Eianzahl von 4,7 (3 – 9). Allerdings besitzen die Weibchen in diesem Gebiet eine durchschnittliche Carapaxlänge von 19 Zentimetern. Das kleinste trächtige Weibchen war 15,7 cm groß. Gelegegrößen korrelierten mit der Carapaxlänge, ein zusätzliches Ei je 2 cm längere Carapaxlänge (Horne et al. 2003). Daher werden die Weibchen aus dem Leaf und Chickasawhay River kleinere Gelegegrößen produzieren. Bei ihnen ist auch noch nicht bekannt, mit welcher Größe sie geschlechtsreif werden, aber mit Sicherheit mit einer kleineren Größe als 15, 7 cm.
Horne et al. (2003) konnten bei nur 6 von 37 Weibchen, die sie mehrmals eingefangen hatten, in Röntgenaufnahmen sicherstellen, dass sie alljährlich mehr als ein Gelege absetzten (16,2 %). Die meisten Weibchen scheinen nur ein Gelege während einer Legesaison zu produzieren und manche wurden überhaupt nie trächtig gefunden. Das lässt den Verdacht aufkommen, dass sich einige Weibchen nicht jedes Jahr fortpflanzen. Nicht bessere Ergebnisse brachten Ultraschalluntersuchungen von denselben Autoren und Shelby et al. (2000). Von 97 Weibchen hatten 76 (78,3 %) entweder beschallte Eier oder entwickelte Follikel in sich und schafften somit ein Gelege pro Jahr. Bei 12 (12,4 %) Weibchen fand man sowohl Eier als auch genügend Follikel, um zwei Gelege zu produzieren. Eines der 97 Weibchen hatte das Potenzial für drei Gelege in einer Saison. Von weiter nördlich ansässigen Weibchen weiß man jedoch, dass sie alljährlich bis zu drei Gelege produzieren können (Vogt pers. Mitteilung in Horne et al. 2003 und Selman & Jones 2011). 50 Prozent der Chickasawhay River Weibchen entwickeln alljährlich 2 Gelege. Im Gegensatz dazu schaffen das nur 17 Prozent der Weibchen aus dem Pascagoula River. Horne et al. (2003), Shelby et al. (2000) und Shelby-Walker et al. (2009) gehen davon aus, dass giftige Abwässer einer Papierfabrik am Leaf River zu Störungen im Hormonsystem und letztendlich zu dieser geringen Reproduktionsfrequenz geführt haben. Selman beobachtete außerdem mehrere sehr lange Spuren von Schildkröten auf den großen Sandbänken am Leaf River, die eventuell von G. flavimaculata Weibchen stammten. Daraus schließt er, dass die Weibchen in Gebieten flussaufwärts längere Zeit für einen geeigneten Nistplatz suchen können (Selman & Jones 2011).
Horne et al. (2003) lokalisierten über 1.500 Nester in den gesamten vier Jahren (1993 – 1997), aber nur 38 davon schlüpften erfolgreich. Der Rest wurde durch Prädatoren oder Überflutungen zerstört. Von 55 Nestern, die von der Ablage bis zum Schlüpfen beobachtet und geschützt wurden, schlüpften nur aus 6 (10,9 %) junge G. flavimaculata. 34 (61,8 %) davon wurden von Nesträubern geplündert und 15 (27,3 %) wurden durch Flutwellen vernichtet. Die Schlupfraten unter natürlichen Bedingungen ergaben 1996 82,8 % und 1997 56,1 %. 25 Eier wurden im Labor ausgebrütet und dabei schlüpften bei konstanten 27,5° C aus 80 % der Eier Jungtiere. Die Eier von G. flavimaculata sind durchschnittlich 36,8 mm lang und 22,9 mm im Durchmesser (Brauman 1995, in Selman & Jones 2011). Die Inkubationszeit in natürlichen Nestern dauert 62 bis 75 Tage. Die Schlüpflinge verbleiben für gewöhnlich noch ein paar Tage im Nest, bis sich ihr Dottersack eingezogen hat und verlassen dieses zwischen 15. September (möglicherweise aber bereits ab 29. Juli) und 19. Oktober - obwohl auch ein Gelege beobachtet wurde, in dem die Schlüpflinge 56 Tage lang nach dem Schlüpfen bis zum 2. Dezember im Nest verblieben sind (Seigel & Brauman 1995, in Lindeman 2013). G. flavimaculata Schlüpflinge in der Natur erlangen eine Carapaxlänge von 34,3 mm (Brauman 1995, in Selman & Jones 2011).
Die bekanntesten Nesträuber sind Fischkrähen, nicht heimische Feuerameisen und Kettennattern. Waschbären und Wildschweine sind weitere mögliche Prädatoren. Fischkrähen sind allerdings die dominierenden Nesträuber. Sie überfliegen oft die Sandbänke und warten nur darauf, bis sich ein Weibchen zum Nisten begibt, oder sie suchen entlang von Schildkrötenspuren die bereits vergrabenen Eier. Teilweise sind sie so aggressiv, dass sie die Weibchen noch während der Eiablage vertreiben (Horne et al. 2003). An zwei Vorfällen beobachtete Moore (2003), wie eine Fischkrähe Eier aus den Nistgruben erbeutete, während eine P. concinna und eine G. flavimaculata noch mitten unter der Eiablage waren.
Lebenserwartung:
Selman & Jones (2011) vermuten bei Männchen eine Lebenserwartung von über 30 Jahren und für Weibchen sogar mehr als 50 Jahre. Besonders alte Tiere weisen Kratzer und Erosionen am Carapax und Plastron auf. Speziell bei den Weibchen verblasst die wunderschöne Fleckenzeichnung am Carapax. Viele der gekennzeichneten Tiere aus den Neunzigern zeigten in den darauf folgenden 13 bis 14 Jahren kein Wachstum (Selman & Jones 2011).
Populationen:
Graptemys flavimaculata wurde lange Zeit als eine der seltensten Schildkrötenarten betrachtet. Durch langjährige Anstrengungen, die den Pascagoula und seine Zuflüsse mit ihrer beindruckenden Artenvielfalt erhalten sollten, konnten weitere Populationsrückgänge bei G. flavimaculata offenbar gestoppt werden. Trotzdem hat diese Art ihre historischen Anzahlen scheinbar nicht wiedererlangt (van Dijk 2013).
Zu der Zeit, als Graptemys flavimaculata von Fred Cagle beschrieben wurde, waren sie noch die dominierende Schildkrötenart im Pascagoula und Chickasawhay River. Cagle wies aber bereits darauf hin, dass sich eingeleitete Schadstoffe der Industrie negativ auf die Bestände auswirken könnten. Erste Rückgänge wurden in den 80er Jahren verzeichnet. Jeffrey Lovich besuchte 1986 den Leaf River und fand dabei flussabwärts einer bekannten Papierfabrik weder G. flavimaculata noch G. gibbonsi, allerdings gute Schildkrötenbestände flussaufwärts der Fabrik, vor (Ernst & Lovich 2009). 1989 untersuchte das US. Fish und Wildlife Service mit Booten 54 Meilen im Pascagoula und Leaf River und 20 Meilen im Chickasawhay River. Dabei registrierten sie weniger als 4 sonnende G. flavimaculata auf einer Flussmeile. Nur im Mündungsgebiet des Pascagoula Rivers hatten sie bis zu 70 Exemplare per Meile entdeckt (Stewart 1990). Selman (2010) vermutet, dass sie die Schildkröten mit den Booten beim Sonnen verschreckt hatten, bevor sie überhaupt in Sichtweite kamen, sonst wäre es nicht zu den geringen Zahlen gekommen. Ergebnisse aus Rückfangmethoden des USFWS im Unterlauf des Pascagoula River brachten geschätzte Populationsdichten von 336 G. flavimaculata per Flussmeile (209 per/km). Das war im Vergleich deutlich weniger, als die damals bekannten Dichten von 549 G. oculifera per Meile, die aber bereits 1986 als bedrohte Art in den Endangered Species Act (ESA) aufgelistet wurde (Stewart 1990). Folglich wurde auch G. flavimaculata 1991 als bedrohte Art in den ESA aufgenommen.
1994 und 1995 erforschte Peter Lindeman drei Flusssysteme und führte Zählungen der ansässigen Graptemys-Populationen durch. Im Zuge seiner Errechnung stellte er fest, dass im Vergleich zu G. flavimaculata doppelt so viele G. oculifera im Pearl River leben und mehr als dreimal so viele G. ouachitensis im Tennessee Flusssystem vorkommen (Lindeman 1998, 1999). Außerdem bestätigte Lindeman wie auch Lovich, dass in den gesamten drei Flusssystemen nur am Leaf River Flussabschnitte auftraten, in denen er überhaupt keine Schildkröten vorfand. Ein Zufluss des Leaf Rivers besaß deutlich mehr Schildkröten. Dies führte er folglich auch auf die Verseuchung des Wassers durch die Papierfabrik zurück.
Zwischen 2005 und 2008 gab es erneut Zählungen, dieses Mal aber sehr intensive. Will Selman und seine Mitarbeiter untersuchten das gesamte Einzugsgebiet des Pascagoula Rivers. Mit Ferngläsern und Spektiven zählten sie ausgehend von insgesamt 160 Brücken, entlang von Sandbänken und vom Kajak oder Boot aus, sonnende Schildkröten. Darüber hinaus fingen sie Graptemys mit offenen Sonnenfallen, die sie unter den Ästen oder Baumstämmen angebracht hatten, per Hand oder mit großen Keschern. Wie er mir in einer späteren Email mitteilte, war dies gar nicht so einfach. Die Schildkröten mieden die Äste und Baumstämme, an denen die Sonnenfallen angebracht waren, kletterten weiter nach oben, um nicht darin zu landen, übersprangen die Fallen und taten auch sonst alles Mögliche, um den Sonnenfallen auszuweichen. Erst nach ein paar Jahren hatte er genug Erfahrung im Schildkrötenfangen gesammelt. Man muss sie überlisten und schlauer sein als sie (Selman pers. Mittlg.). Nachdem sie eine Graptemys eingefangen hatten, wurde diese für nachfolgende Mark-Resight-Erhebungen mit einem wasserfesten Farbspray am Carapax markiert. In den Jahren 2005 bis 08 hatten sie dann in verschiedenen Abschnitten der drei größeren Flüsse (Pascagoula, Leaf und Chickasawhay) sowohl die nichtmarkierten als auch die markierten Schildkröten abgezählt. Jedes der beobachteten Flusssegmente war 2 bis 3,75 km lang. Um die Populationsgröße letztlich abschätzen zu können, wurden die Daten (Differenz zwischen markierten und nichtmarkierten Schildkröten) aus den Zählungen mit dem NOREMARK Populationsschätzungsprogramm (White 1996) analysiert.
Die Ergebnisse aus dieser Studie waren erfreulich, denn die
Populationsschätzungen ergaben weitaus größere Bestände als in vergangenen Zeiten. Im gesamten Flusssystem war von 1.041 gezählten Schildkröten Pseudemys concinna mit 39 % die häufigste
Schildkröte, gefolgt von Graptemys flavimaculata mit 29 %. Graptemys flavimaculata ist somit zwar nicht mehr die zahlreichste Schildkrötenart im Pascagoula River System, aber die
dominierende in den großen Flüssen (40 %), speziell im Pascagoula River (84 % von allen Schildkröten) und im Leaf River (63 %). Nur bei 31 der 160 Brücken war G. flavimaculata präsent. Wenn aber welche zu sehen waren, dann sonnten sich gleich mehrere (in der Regel 9,83 Stück).
In kleineren Flüssen und großen Bächen war G. flavimaculata – nach P. concinna, G. gibbonsi, Apalone ssp. und Trachemys scripta elegans – die
fünfthäufigste Schildkröte.
Die Mark-Resight-Populationsschätzungen brachten folgende Resultate: 2005 hatte ein 2,4 km langes Segment am Chickasawhay River, in Greene County, eine berechnete Anzahl von 232 (93 per km) G.
flavimaculata (95 % Konfidenzintervall 127 – 419 Stück). Am Leaf River in Forrest County hatten die Forscher von 2005 bis 2008 alljährlich die Populationen abgezählt sowie geschätzt und kamen im
Untersuchungszeitraum zum Ergebnis, dass 257 bis 451 (95 % KI: 145 – 1143) G. flavimaculata in einem 3,2 bis 3,75 km langen Flussabschnitt leben. Das ergibt 80 bis 120 Schildkröten auf einen
Flusskilometer am Leaf River (Selman & Qualls 2009). Im Escatawpa River schätzt man ca. 500
Individuen auf nur 15 bis 20 Flusskilometer. G. flavimaculata bewohnt in diesem Fluss nur den Unterlauf (Selman et al.
2013b).
Im unteren Pascagoula River in der Nähe von Vancleave, in dem schon
immer die größten und stabilsten Graptemys flavimaculata Populationen dokumentiert wurden, vermutete man im Oktober 2005 einen Bestand von 1203 Exemplaren (95 % KI: 786 – 2077), in einem 2
km langen Sektor, das sind demzufolge 602 Schildkröten per Flusskilometer. Dies ist die höchste Populationsdokumentierung, die jemals bei G. flavimaculata gemacht wurde (Selman & Qualls 2008c). Nachdem der Hurrikan Katrina wenige Monate zuvor, Ende August 2005, die Golfküste
erreichte und obwohl es die größte Naturkatastrophe seit den Aufzeichnungen am Pascagoula River war, hatte es bei G. flavimaculata scheinbar keine großen Verluste gegeben. Zwar wurden große
Mengen an toten Fischen, aber kaum verendete Schildkröten gefunden. Außerdem hatte man noch Schildkröten gesehen, die vor dem Hurrikan an derselben Stelle markiert wurden. Eventuell sind sie während
der Sturmfluten aus dem starken Strömungsbereich in überschwemmte Gebiete ausgewichen.
In den Jahren nach dem Hurrikan (2006, 2007 und 2008) wurde in der Auswertung ersichtlich, dass im selben 2 Kilometer langen Abschnitt nur noch annähernd 641 bis 583 (95 % KI: 381 – 989) G.
flavimaculata vorkamen (321 – 292 per Kilometer). Das entspricht einem Rückgang von ca. 47 Prozent. In diesen drei Jahren hatten sich die Populationsdichten offensichtlich auch nicht wieder
erholt. Lindeman (2013) vermutet, dass sie aus dem Gebiet abgewandert sind. Durch den Hurrikan gab es eine riesige Meerwasserflut, die sehr viel
Salzwasser ins Landesinnere brachte. Die Flusspegel stiegen ca. 4 Meter über normale Werte. Selman & Qualls (2008c) gehen davon aus, dass sich die Wasserqualität dadurch massiv verschlechtert hat und hiermit verbunden auch die primären Nahrungsquellen für G.
flavimaculata eliminiert wurden. Positiv ist jedoch, dass die Anzahl von Jungtieren in den drei Jahren nach dem Hurrikan rapide zugenommen hat. Da die Jahre nach dem Hurrikan von Trockenheit
geprägt waren, könnten sich die Überflutungen und die Anwesenheit von Nestprädatoren in Grenzen gehalten haben (Selman & Qualls 2009).
Aus der Hochrechnung der Ergebnisse von Mark-Resight-Schätzungen und der Anzahl der Schildkröten, die man beim Sonnen gezählt hat, ergibt sich eine annehmbare Gesamtpopulationszahl von 50.000 Exemplaren (Selman pers. Mitt. 2009, zit. in Lindeman 2013). Trotzdem hält Peter Lindeman Graptemys flavimaculata für die drittseltenste Höckerschildkröte, basierend auf ausführlichen Beobachtungen aller Graptemys-Arten (Lindeman pers. Mitt. 2009, in van Dijk 2013). Zwischenzeitlich ist sie, seitdem Graptemys pearlensis 2010 beschrieben wurde, als die viertseltenste Art der Gattung Graptemys anzusehen. Sowohl G. pearlensis als auch die mit G. flavimaculata sympatrisch lebende G. gibbonsi haben weitaus geringere Bestände. G. gibbonsi weist laut den Brückenbeobachtungen eine um 55 Prozent geringere Gesamtpopulation auf, siehe Genaueres bei G. gibbonsi.
Bedrohungen:
Im Jahr 2003 zählte Graptemys flavimaculata mit Platz 25 zu den am meistgefährdetsten Schildkröten weltweit. 2007 erschien G. flavimaculata auf Platz 5 und G. gibbonsi auf Platz 3 der meistgefährdetsten Schildkröten Nordamerikas, gefolgt von Pseudemys alabamensis auf Platz 2. Glyptemys muhlenbergii ist nach wie vor die gefährdetste Art. Mittlerweile weiß man aber, dass keine nordamerikanische Schildkrötenart annähernd so stark gefährdet ist wie asiatische Arten (IUCN/SSC Tortoise and Freshwater Turtle Specialist Group/Turtles in Trouble).
Im Pascagoula River gelten etwa 17 Tierarten als bedroht oder gefährdet, hauptsächlich sind es verschiedene Muschelarten (Lovich et al. 2009, www.mdwfp.com). Auch der Weißkopfseeadler (Haliaeetus leucocephalus), viele Fischarten – wie der Golfstör (Acipenser oxyrinchus desotoi) – und schließlich auch die beiden endemischen Graptemys-Arten, sind als stark bedroht anzusehen.
Die Liste der Bedrohungen für die beiden Graptemys-Arten ist lang. Am Zusammenfluss des Bowie Rivers mit dem Leaf River führte das Ausbaggern des Flussbettes zu erhöhter Sedimentbelastung flussabwärts am Leaf River (Jones 1993). Wasserverschmutzungen waren und sind eines der größten Probleme im gesamten Pascagoula Flussbecken und ein dementsprechend mitverantwortlicher Grund für den Populationsrückgang. Während man in den Siebzigern am Chickasawhay River nach Öl bohrte, führten Salzwassereinleitungen zu Wasserproblemen. Städtische und industrielle Abwässer hatten Auswirkungen auf die Wasserqualität im Tallahala Creek und nach wie vor im Bowie und Leaf River in der Umgebung von Hattiesburg (Stewart 1990, Jones 1993, Selman & Jones 2011). Den größten Schaden hatte mit Sicherheit eine der 10 größten Papierfabriken Nordamerikas angerichtet, die sich am Leaf River in New Augusta befindet. Nach der Inbetriebnahme 1984 wurden über einen Zeitraum von 11 Jahren gefährliche Substanzen eingeleitet. Unter anderem Polychlorierte Biphenyle (PCB) und das hochgiftige 2,3,7,8-Tetrachlordibenzodioxin (TCDD), welches als endokriner Disruptor bekannt ist und auch bei geringer Menge eine Veränderung im Hormonsystem verursachen kann. Derartige Verunreinigungen rotten vor allem die primären Nahrungsquellen dieser Schildkröten aus (Stewart 1990). 1992 kam es unfallbedingt zu einer gewaltigen Abwasserentsorgung in der Fabrik, woraufhin 30 Kilometer flussabwärts viele tote Fische und Schildkröten vorgefunden wurden (Jones pers. Mitt., in Shelby et al. 2000). Das Mississippi Department of Wildlife, Fisheries and Parks hatte aufgrund der erhöhten TCDD-Werte bei Fischen den kommerziellen Fischfang 1989 verboten und vom Verzehr von Fischen aus dem Leaf und Pascagoula River abgeraten. Das Fangverbot wurde erst 1995 wieder aufgehoben (Jones 1993, Lindeman 2013). Die Wasservergiftung dürfte eine klare Erklärung dafür sein, dass Jeff Lovich bereits 1985 unterhalb dieser Fabrik keine Schildkröten mehr vorfand (Ernst & Lovich 2009) und das USFWS (Stewart 1990) verhältnismäßig viele Schildkröten im Mündungsgebiet gezählt hatte. Scheinbar sind damals viele Schildkröten dorthin abgewandert, um der Schadstoffbelastung auszuweichen. 20 Jahre später entdeckten Selman und Qualls (2009) in diesem Flussgebiet bei New Augusta am Leaf River erfreulicherweise die größten Dichten von G. flavimaculata und G. gibbonsi, was auf die zwischenzeitliche Klärung des Abwassers und auf die chlorfreie Produktion der Papierfabrik zurückzuführen ist.
1996, 1997 und 1998 versuchten Shelby et al. (2000), Shelby & Mendonca (2001) und Shelby-Walker et al. (2009) herauszufinden, ob es bei Graptemys flavimaculata durch das Dioxin zu einer Störung im Hormonsystem gekommen ist. Dafür prüften sie in zwei verschiedenen Populationen Blutplasma der Schildkröten auf Testosteron- und Estradiolwerte - zum einem von dem vorbelasteten Gebiet (Pascagoula River, ca. 90 km flussabwärts der Fabrik) und zum anderen vom höchstwahrscheinlich unbelastetem Chickasawhay River. Tatsächlich erwiesen sich, obwohl die giftige Wasserbelastung 1995 verringert wurde und 1996 auch keine erhöhten TCDD-Werte in Fischgeweben nachweisbar waren, bei den Männchen unterschiedliche Testosteron-Level. Die Pascagoula Männchen hatten wesentlich geringere Testosteronwerte als die Männchen des unbelasteten Chickasawhay Rivers. Außerdem wiesen 10 Prozent der Pascagoula Männchen gleich hohe Estradiolwerte wie die Weibchen auf. Weibchen aus dem Chickasawhay River hatten während der präovulatorischen Phase (Follikelreifung) die erwarteten signifikant erhöhten Estradiolwerte und die Vitellogenin-Levels korrelierten mit dem E2-Level. Bei den Pascagoula Weibchen korrelierte dies nicht und sie zeigten auch kein erhöhtes E2 während der Follikelreifung. Aus dieser Feststellung schließen die Wissenschaftler eine ovarielle Dysfunktion, da auch nur 17 % der Pascagoula Weibchen ein zweites Gelege produzierten, im Gegensatz zu 50 % der Chickasawhay Population (Shelby- Walker et al. 2009). Es wurden keine Untersuchungen bei G. flavimaculata erhoben, während der Fluss durch das Dioxin verseucht wurde. Schlussendlich konnten auch Kannan et al. (2000) Jahre nach der Kontamination keine gravierenden Vergiftungen in Leber- und Muskelgewebeproben feststellen. Das meiste der belegten toxischen Verbindungen waren polychlorierte Biphenyle (PCB) und Pestizide (DDT), allerdings in weitaus geringerer Menge, wie man es bei Schnappschildkröten oder Diamantschildkröten bereits gefunden hatte. Beachtlich ist aber, dass Jahre später noch immer endokrine Störungen belegt werden konnten. Shelby & Mendonca (2001) und Shelby-Walker et al. (2009) befürchten, dass diejenigen Schildkröten, die dem TCDD 11 Jahre lang ausgesetzt waren, eine langzeitliche Schädigung im Fortpflanzungssystem davon getragen haben.
Zwischenzeitlich wird Graptemys flavimaculata infolge von Habitats Zerstörungen, d. h. durch Entfernung von Baumstämmen, Kanalisierung und übertriebene Wasserentnahme gefährdet (Selman & Jones 2011). Dem Pascagoula River werden für Bewässerung, Viehzucht und Industrie täglich ca. 213 Millionen Liter Wasser entzogen (www.usgs.gov). Ein geplantes Ölbevorratungsprojekt würde den Pascagoula River täglich weitere 190 Millionen Liter Wasser kosten (Selman & Qualls 2009).
Primär gerät G. flavimaculata durch den starken Bevölkerungszuwachs im südöstlichen Mississippi unter Druck. Während Graptemys flavimaculata in den nördlichen Flüssen noch am weitgehendsten ungestört lebt, lassen die frequentierte Nutzung des Pascagoula Rivers als Erholungsgebiet und der damit verbundene starke Bootsverkehr eine natürliche Lebensweise kaum noch zu.
No place to nest or bask (Keine Platz zum Nisten und Sonnenbaden) – so lautet der Titel einer Studie von Moore und Seigel (2006). Wie unter dem Punkt Reproduktion bereits erwähnt, beobachten die Weibchen für längere Zeit die Sandbänke, bevor sie sich zum Nisten begeben, von durchschnittlichen 160 Minuten bis hin zu sechseinhalb Stunden. Ein Weibchen wartete über 10 Stunden, ein Nistverhalten konnte dann nicht mehr beobachtet werden. Möglicherweise warten sie sogar mehrere Tage. Nur an 18 von 54 Observierungstagen konnten Moore und Seigel Weibchen beobachten, die sich auf den Weg zur Sandbank machten. Davon konnten von 79 Nistversuchen nur 15 Weibchen erfolgreich die Eiablage beenden. Die anderen Weibchen brachen das Nistverhalten aufgrund vielfältiger Störungen ab und kehrten sofort zum Wasser zurück. Etwa die Hälfte der Tage ließ genug Spielraum zwischen den Störungen über, sodass die Weibchen die erforderliche Stunde zur Eiablage hatten. Ein ähnliches Schema zeigt sich beim Sonnenverhalten. Durchschnittlich verkehrt an den Wochentagen alle 65 Minuten ein Boot. An den Wochenenden fahren dermaßen viele Boote (alle 7,5 Minuten), sodass die Zeit zwischen den Behinderungen quasi gegen Null geht (Selman et al. 2013a). Jeder, der das Verhalten von Graptemys kennt, weiß, dass sie sich unter solchen Umständen unmöglich sonnen werden. Sobald sie von einem vorbeifahrenden Boot verschreckt werden, dauert es natürlich eine gewisse Zeit, bis sie sich erneut sonnen, bis dahin kommt aber schon wieder das nächste Boot. Selman et al. (2009) sahen außerdem mehrmals, wie sonnende Graptemys von Abfällen gestört wurden. Meist waren es Styroporplatten von Hausbooten. Einmal hatte sie ein vorbeitreibender Fernseher beim Sonnen verscheucht.
Dass anhaltender Bootsverkehr auch physiologische Konsequenzen mit sich zieht, konnte in weiterer Folge von Selman et al. (2013a) belegt werden. Die Anzahl der registrierten Boote in Jackson County stieg von 2.033 Booten in den Jahren 1987/88 auf 6.194 in 2007/08. Das ist ein Anstieg von 300 %. Im Vergleich zur Leaf-River-Population (38.4 Minuten [Männchen 36,2 min, Weibchen 42,8 min] sonnen sich die G. flavimaculata am Pascagoula für kürzere Zeiten (26,5 Minuten [Männchen: 26,9 min, Weibchen: 25,8 min]). Besonders bei den Weibchen ergeben sich deutliche Unterschiede, Letztere flüchten auch häufiger ins Wasser als die Männchen. Die Forscher folgern daraus eine fortlaufend geringere Körpertemperatur, eine niedrigere Stoffwechselrate und mitunter die erwähnte geringe Fortpflanzungsfrequenz. Die Veränderung des Verhältnisses von Heterophilen zu Lymphozyten als Indikatoren für Stress wurde ebenfalls von Selman et al. (2013a) geprüft. Dabei stellte sich heraus, dass die Pascagoula-Schildkröten maßgeblich höherem Stresslevel unterliegen als diejenigen aus dem Leaf River. Zudem leiden die oft gestörten Schildkröten unter Panzerproblemen (Plattenwechselschwierigkeiten, Pilz- und Bakterieninfektionen). Ein Weibchen befand sich in einem ähnlich schlechten Zustand, wie es von Höckerschildkröten bekannt ist, die unter ungeeigneten Lichtquellen gehalten werden. Leider berichten die Autoren auch von einer direkten Mortalität durch Boote. Sie sahen oft angeschwemmte tote Schildkröten, die offensichtlich von Schnellbooten oder Bootsschrauben getroffen wurden. Vermutlich wird die tatsächliche Anzahl der dadurch getöteten Schildkröten noch unterschätzt, da die meisten nach dem Verenden zu Boden sinken (Selman et al. 2013a).
Nach wie vor wird im Pascagoula-River-System auf sich sonnende Schildkröten geschossen. Dies wird als „Turtle plinking“ bezeichnet. Mit gelegentlichem Beifang von Fischern und illegalem Absammeln für den Tierhandel ist ebenfalls noch immer zu rechnen (Selman et al. 2013b).
Die Nutzung der Sandbänke als Badestrände für Picknicke, das Quadfahren und Campen übt eine direkte und indirekte Mortalität auf die Nester aus, wenn Personen auf den Nestern herumtrampeln, darüber Lagerfeuer anzünden oder die Nester ungewollt freilegen. So werden sie schnell leichte Beute für Prädatoren und zurückgelassene Essensreste locken immer mehr Fischkrähen an (Moore 2003, Moore & Seigel 2006). Horne et al. (2003) errechneten, dass alleine die hohe Sterberate durch Nesträuberei und, falls sich die Fortpflanzungsrate nicht wieder erhöht, dies durch ein sehr hohes Alter der Weibchen ausgeglichen werden müsste, damit diese Art langfristig gesehen nicht irgendwann verschwindet.
Mehrere nichtnative Tiere und Pflanzen bedrohen das Fortbestehen von G. flavimaculata. Die oberen Teilstücke der Sandbänke überwuchern mit invasivem Silberhaargras (Imperata cylindrica), Spitzkletten (Xanthium strumarium) und Chinesischen Talgbäumen (Triadica sebifera). Das verleitet die Weibchen dazu, ihre Eier eher in Ufernähe, in häufig überfluteten Zonen, abzulegen oder die Nester werden durch die Pflanzen beschattet, was letztendlich zu einem ungünstigen Geschlechterverhältnis führt (Selman & Jones 2011). Zwei invasive Wasserpflanzen, Wasserhyazinthen (Eichhornia crassipes) und Alligatorkraut (Alternanthera philoxeroides) halten G. flavimaculata vom Sonnenbaden ab. Selman & Jones (2011) beobachteten, dass Schildkröten Sonnenplätze gemieden hatten, wenn diese von den Schwimmpflanzen umgeben waren. Sobald die Pflanzenteppiche entfernt wurden, sonnten sich die Schildkröten wieder.
In Zukunft könnte auch der Klimawandel diesen Schildkröten zu schaffen machen. Hurrikans, extreme Trockenperioden, erhöhte Niederschlagsmengen und steigende Temperaturen könnten wiederum zum einseitigen Geschlechterverhältnis führen. Lindeman (2013) spricht auch von einer möglichen Bedrohung durch einen ansteigenden Meeresspiegel. Wenn dieser um 5 Meter ansteigt, wird bereits der Lebensraum der größten G. flavimaculata Population des Pascagoula Rivers überflutet. Ein Anstieg um lediglich 13 Meter würde den gesamten Pascagoula River überschwemmen und ein Anstieg um 27 Meter auch den Lebensraum der dominierenden Population am Leaf River bis nach Hattiesburg auslöschen.
Schutzmaßnahmen:
Graptemys flavimaculata ist seit 1975 vom Bundesstaat Mississippi als gefährdete Art aufgelistet (Selman & Jones 2011). Nachdem sie vom U.S. Fish and Wildlife Service als bedrohte Art auf nationaler Ebene unter Schutz gestellt worden sind (Lohoefener 1991), gab es umfassende Bestrebungen, die verbliebenen Populationen zu retten beziehungsweise die Bestände aus früheren Zeiten wiederzuerlangen. Das U.S. Fish and Wildlife Service veröffentlichte dazu einen Erhaltungsplan für G. flavimaculata, der auf eine geschätzte Dauer von 15 Jahren und mit Kosten von 845.000 Dollar berechnete wurde (Jones 1993). Nicht alles, aber vieles davon wurde seitdem erfüllt. Eines der obersten Ziele war die Erforschung der Lebensgeschichte und Ökologie. Der Plan erforderte auch ansteigende Populationsdichten, sodass im Pascagoula 44 G. flavimaculata per Flusskilometer beim Sonnen gezählt werden können und 22 im Leaf und Chickasawhay River. Das wurde nach den Untersuchungen von Selman & Qualls (2009) in den Oberläufen des Leaf und Chickasawhay Rivers zwar nicht erreicht, aber in den Unterläufen der beiden Zuflüsse und im gesamten Pascagoula River teilweise bei weitem übertroffen. Darüber hinaus sollten 129 Kilometer Flusslauf entlang des Pascagoulas und die unteren Abschnitte des Leaf und Chickasawhay Rivers als Nuturschutzgebiet eingerichtet werden. Auch das konnte durch staatseigene Naturschutzgebiete oder durch private Landeigentümer (Charles M. Deaton- und Herman Murrah WMA) erfüllt werden. Zirka 28.000 Hektar Land sind geschützt. In den Schutzgebieten werden die Sandbänke vom invasiven Silberhaargras freigehalten. In der Ward Bayou WMA sind von 1. April bis 1. Oktober, von jeweils 5 Uhr Nachmittags bis 8 Uhr morgens, vier kleinere Sandbänke für die Öffentlichkeit gesperrt. Außerdem sind keine Hunde erlaubt und Müllverschmutzung ist ebenso verboten. Keinerlei Holz darf ohne schriftliche Genehmigung für jegliche Zwecke verwendet werden. Insgesamt gibt es in den Schutzgebieten strenge Vorschriften und es muss Eintritt bezahlt werden (Selman & Jones 2011, Lindeman 2013, www.mdwfp.com).
Um diese Art für wissenschaftliche Zwecke überhaupt anfassen zu dürfen, braucht man eine Sondergenehmigung des U.S. Fish und Wildlife Services oder des Mississippi Departments of Wildlife Fisheries and Parks, geschweige denn, dass man sie einfach so aus der Natur entnehmen dürfte. Dies wird laufend durch die Behörden kontrolliert. Der Besitz dieser Art ist im Staate Mississippi generell verboten. Es existiert die Geschichte zweier deutscher Staatsbürger, die man in den neunziger Jahren des Einfangens wildlebender G. flavimaculata verdächtigt hatte. Sie wurden daraufhin verhaftet und in Untersuchungshaft gestellt. Dabei handelt es sich um eine peinliche Story, da sie auch von Lindeman in seinem Graptemys-Atlas erwähnt wird.
Der ursprüngliche Schutzstatus als Endangered 1996, in der Roten Liste der Weltnaturschutzunion IUCN, wurde 2011 aufgrund der positiven Populationsentwicklung und der verbesserten Wasserwerte auf Vulnerable abgelistet. Graptemys flavimaculata ist wie alle Graptemys-Arten seit 2006 im Washingtoner Artenschutzübereinkommens in Anhang III aufgelistet.
Letztlich wird in Museen und Schulen das öffentliche Bewusstsein für Naturschutz gefördert und die Bewohner des Pascagoula River Flussgebietes werden über gefährdete Arten in Kenntnis gesetzt, insbesondere ihrer Yellow-blotched Sawback.
In Zukunft sollte der Populationstrend weiter überwacht werden, mit besonderem Fokus auf die Escatawpa-River-Bestände (Selman et al. 2013b). Der Bootsverkehr sollte auf die Nutzung kleiner oder mittelgroßer Boote limitiert werden, da große Boote diese Schildkröten am häufigsten stören. Zudem verursacht der Wellengang eine Erosion der Sandbänke (Selman & Jones 2011). Die Autoren erbitten auch eine Erweiterung der Schutzgebiete im Escatawpa River und der Nordwestseite des Pascagoula Rivers. Der Leaf River flussaufwärts von Hattiesburg sollte ebenfalls unter Schutz gestellt werden, zumal hier die größte nördliche Population von G. flavimaculata sowie eine beträchtliche von G. gibbonsi lebt.
Graptemys flavimaculata in Menschenhand:
Bereits etwa 10 Jahre nach der Erstbeschreibung taucht G. flavimaculata,
mit nachweislichen Wildfängen vom Leaf River in Europa und gleich dazu der erste Haltungsbericht auf (Peters 1968). Wie viele Wildfänge tatsächlich nach Europa gelangt sind, ist nicht mehr nachzuvollziehen. Letzte Importe gab es laut Hertwig (2001) Mitte der Achtziger. Nach der Jahrtausendwende haben sich die Nachzuchtbestände in Deutschland und Österreich laut W. Sachse (pers. Mitt. an Selman & Jones 2011) auf fünfzig bis einhundert Exemplare gesteigert. Zwischenzeitlich sind sie weiter rapide angestiegen, denn im Zuchtbuch befinden sich schon zirka 90 Tiere. Darin sind allerdings die Liebhaber-Männchen und auch die sämtlichen nicht bekannten G. flavimaculata aus dem deutschsprachigem Raum, Italien und Frankreich nicht mit eingerechnet. Daher dürften sich m. E. weit mehr als 200, wenn nicht sogar um die 300, G. flavimaculata in Europa befinden (Stand 2015). Die Tendenz ist weiterhin stark steigend, da es in Europa schon mehr Züchter von G. flavimaculata als von G. nigrinoda gibt. Zu erwähnen ist aber, dass sämtliche Schildkröten dieser Art nur von ein paar wenigen Wildfängen abstammen - laut unseren Recherchen von nur 10 bis 20 Tieren. Davon leben manche noch, es sind sogar noch Weibchen aus den Siebzigern bekannt, die zwischenzeitlich über 40 Jahre alt sind.
In den USA wurde vor 1991 eine Graptemys flavimaculata noch um 65 Dollar im Handel angeboten (Stewart 1990). Nachdem sie auf staatlicher Ebene unter Schutz gestellt wurden, stiegen die Preise auf unglaubliche 3.000 Dollar pro Exemplar (R. Jones, pers Mitt. in Lindeman 2013). Im Moment werden sie in den USA für 400 bis 700 Dollar angeboten. In den Vereinigten Staaten leben ca. 200 adulte Graptemys flavimaculata in Menschenobhut, davon knappe hundert in 10 Instituten, wovon das Tennessee Aquarium mit ca. 60 Stück die größte Sammlung besitzt. Das Tennessee Aquarium führt auch ein Zuchtprogramm für diese Art und hat manche Tiere bei anderen Instituten eingestellt. Da der Handel mit G. flavimaculata in den Vereinigten Staaten infolge der Auflistung in den ESA aber stark eingeschränkt ist, dürfen sie nicht zwischen den Staaten gehandelt werden. Darum werden in den Zoos und Aquarien die meisten Eier nicht ausgebrütet (Selman & Jones 2011, Lindeman 2013).
Graptemys flavimaculata ist natürlich auch in China und Japan heiß begehrt. In Japan werden nach wie vor über 1.000 Euro für eine Nachzucht bezahlt. Auch in asiatischen Ländern stammen viele G. flavimaculata aus europäischen Nachzuchtbeständen (H. Hersche pers. Mittlg.).
In der Haltung unterscheiden sie sich von anderen Graptemys-Arten eigentlich nicht. Sie sind auch nicht empfindlicher als die anderen beiden Sawbacks. So ist sie auch für Neueinsteiger geeignet. Allerdings ist allseits bekannt, dass die Zucht von G. flavimaculata schwieriger als beispielsweise bei G. nigrinoda ist. Mäßige Gelege- und Eieranzahlen, unbefruchtete Eier und das Absterben von Embryonen sind ein häufiges Problem, wobei es noch keine plausible Erklärung dafür gibt. Ein Grund hierfür könnte aber in den Wildfängen liegen, die zu den Zeiten abgesammelt und nach Europa exportiert wurden, als die Papierfabrik das Dioxin in den Fluss freigesetzt hat. Das ist zwar nur eine Vermutung von mir, aber diese ist durchaus berechtigt, da Dioxin (TCDD) möglicherweise zu einer lebenslangen Beeinträchtigung in der Fortpflanzung führt, wenn Tiere diesem Gift während der Wachstumsphase ausgesetzt sind (Shelby & Mendonca 2001). Wie sich die Zucht mit unseren Nachzuchten weiterentwickelt, kann man noch nicht genau sagen.
Es ist einleuchtend, dass die ex situ-Populationen aufgrund der geringen Abstammung von Wildtieren und der hohen Anzahl von Nachzuchttieren, die daraus bereits hervorgegangen sind, in Zukunft etwas von ihrer genetischen Variabilität einbüßen werden. Das will zwar niemand hören, aber es ist ein klarer Fakt in der Populationsgenetik. Wenn eine Population stark dezimiert wird und dann wieder wächst – wie es im Prinzip bei unseren G. flavimaculata Nachzuchten der Fall ist – unterscheidet sich die Genfrequenz hinterher meist von denen der ursprünglichen Population oder kann sogar zu dramatischen Änderungen der Gene führen, unabhängig von der natürlichen Selektion. Bei solchen Ereignissen können viele vorteilhafte Anpassungen verloren gehen. Man spricht vom Gendrift oder Flaschenhalseffekt, die Folge davon ist Inzuchtdepression. Interessant und allenfalls positiv in diesem Zusammenhang ist die Molekularstudie von Selman et al. (2013b). Alle Graptemys-Arten, die entlang der Golfküste leben, sind gleichzusetzen mit einer Inselpopulation (Lindeman 2013). Die Migrationsrate müsste in einem solch kleinen Flusssystem wie bei G. flavimaculata so hoch sein, dass keine Unterschiede in der Anzahl und den Zustandsformen einzelner Gene nachweisbar sind. Überraschenderweise konnten die Wissenschaftler dennoch eine genetische Struktur in sechs Mikrosatelliten-Loci feststellen. Das heißt, dass sie sich im Laufe der Zeit nicht gebietsübergreifend verpaart haben, sondern ihre vermutete Standorttreue beibehielten. Resultierend daraus existieren differenzierte Allele im gesamten Verbreitungsgebiet. Die Tiere im Kerngebiet (im Zusammenfluss der drei größeren Flüsse) verfügen über die häufigste Anzahl von Allelen. Jede Population der drei großen Flüsse verfügt über ein bis vier einmalige Allele, welche wiederum nicht in den anderen beiden gefunden wurden. Reduzierte Mengen von Allelen fand man bei den Schildkröten im oberen Chickasawhay River und speziell bei der Escatawpa-River-Population. Die Werte unterscheiden sich aber trotzdem nicht signifikant von den anderen. Besonders die Escatawpa-River-Population ist in gewisser Weise mit unseren vergleichbar: eine kleine Anzahl von Tieren, die bereits sehr lange überlebte und möglicherweise nur einen kleinen Ausschnitt von Allelfrequenzen mitbekommen hat. Hier sprechen die Autoren – im Gegensatz zu den anderen Populationen – von einem erhöhten Potenzial für eine mögliche Inzuchtdepression und einem Verlust von genetischer Variabilität in ferner Zukunft. Ihre Analysen zeigten aber dennoch keinen historischen oder aktuellen genetischen Flaschenhals. Noch kleinere Gruppen leben in abgeschiedenen Bächen, die teils mehr als 10 Kilometer von den Hauptflüssen entfernt liegen und durch geographische Barrieren davon abgeschnitten sind. Wahrscheinlich nutzen sie diese auch das ganze Jahr, davon gehen Selman & Qualls (2009) aus. Meines Erachtens muss diese Art eine gewisse Resistenz gegenüber Inzuchtdepressionen besitzen, sonst gäbe es sie, insbesondere die Tiere aus dem Escatawpa River, nicht mehr.
Ziel des Zuchtbuches ist es zum einen, die Übersicht zu behalten – sonst ist es in wenigen Jahren wieder so, dass niemand mehr weiß, woher seine Tiere stammen – und zum anderen natürlich, möglichst Zuchtgruppen aufzubauen, die nicht eindeutig miteinander verwandt sind. In absehbarer Zeit könnten möglicherweise auch Nachzuchten mit den Instituten aus den USA getauscht werden. Das ist zwar ein riesen Papierkrieg, aber trotzdem machbar (P. Praschag pers. Mitteilung). So gesehen dürften uns die „flavis“, wie sie von Liebhabern immer genannt werden, hoffentlich noch eine Weile erhalten bleiben.
Literatur:
Cagle, F.R. (1954). Two new species of the genus Graptemys. Tulane Studies in Zoology 1:167–186.
Ennen, J. R., B. R Kreiser, C. P. Qualls & J. E. Lovich (2010). Morphological and molecular reassessment of Graptemys oculifera and Graptemys flavimaculata (Testudines: Emydidae). Journal of Herpetology, 44(4), 544–554.
Ernst, C. H. & J. E. Lovich (2009). Turtles of the United States and Canada. Second Edition. The Johns Hopkins University Press, Baltimore, Maryland.
Hertwig, S. (2001). Ökologie, Haltung und Fortpflanzung im Terrarium von Graptemys caglei, G. flavimaculata, G. nigrinoda nigrinoda und G. oculifera. Salamandra, 37(1), 21–48.
Horne, B., R. Brauman, M. Moore & R. Seigel (2003). Reproductive and nesting ecology of the yellow-blotched map turtle, Graptemys flavimaculata: implications for conservation and management. Copeia 2003:729–738.
Jones, R. L. (1996). Home range and seasonal movements of the turtle
Graptemys flavimaculata. Journal of Herpetology 30:376–385.
Jones, R. L. (1993). Yellow blotched map turtle Recovery plan. US Fish and Wildlife Service, 1–18.
Kannan, K., M. Ueda, J. A. Shelby, M. T. Mendonça, M. Kawano & M. Matsuda (2000). Polychlorinated dibenzo-p-dioxins (PCDDs), dibenzofurans (PCDFs), biphenyls (PCBs), and organochlorine pesticides in yellow-blotched map turtle from the Pascagoula River basin, Mississippi, USA. Archives of Environmental Contamination and Toxicology, 38(3), 362–370.
Lamb, T., C. Lydeard, R. B. Walker & J. W. Gibbons (1994). Molecular systematics of map turtles (Graptemys): A comparison of mitochondrial restriction site versus sequence data. Systematic Biology 43:543–559.
Lamb, T. & M. F. Osentoski (1997). On the paraphyly of Malaclemys: A molecular genetic assessment. Journal of Herpetology, 31(2), 258–265.
Lindeman, P. V. (2000). Evolution of the relative width of the head and alveolar surfaces in map turtles (Testudines: Emydidae: Graptemys). Biological Journal of the Linnean Society 69:549–576.
Lindeman, P. V. (1998). Of deadwood and map turtles (Graptemys): An analysis of species status for five species in three river drainages using replicated spotting-scope counts of basking turtles. Linnaeus fund research report. Chelonian Conservation and Biology 3:137–141.
Lindeman, P. V. (1999). Surveys of basking map turtles Graptemys spp. in three river drainages and the importance of deadwood abundance. Biological Conservation 88:33–42.
Lindeman, P. V. (2013). The Map Turtle and Sawback Atlas: Ecology, Evolution, Distribution, and Conservation. University of Oklahoma Press, Norman, Oklahoma.
Lohoefener, R. (1991). Endangered and threatened wildlife and plants; threatened status for the yellow-blotched map turtle, Graptemys flavimaculata. Federal Register 56: 1459-1463.
Lovich, J. E., W. Selman & C. J. McCoy (2009). Graptemys gibbonsi Lovich and McCoy 1992 – Pascagoula Map Turtle, Pearl River Map Turtle, Gibbons’ Map Turtle. Pp. 029.1-029.8 in Conservation Biology of Freshwater Turtles and Tortoises: A Compilation Project of the IUCN/SSC Tortoise and Freshwater Turtle Specialist Group (A. G. J. Rhodin, P. C. H. Pritchard, P. P. van Dijk, R. A. Saumure, K. A. Buhlmann, J. B. Iverson & R. A. Mittermeier, eds.). Chelonian Research Monograph 5: 029.1–029.8.
Moore, M. J. C. (2003). Behavioral ecology of the threatened yellow-blotched map turtle, (Graptemys flavimaculata): implications for conservation and management. Master’s thesis, Southeastern Louisiana University, Hammond, LA.
Moore, M. J. C. & R. A. Seigel (2006). No place to nest or bask: Effects of human disturbance on the nesting and basking habits of yellow-blotched map turtles (Graptemys flavimaculata). Biological Conservation 130:386–393.
Peters, U. W. (1968). Graptemys oculifera und ihre Unterarten. DATZ, 21 (10), 318–319.
Roddewig, E. (2012). Haltung der Gelbtupfen-Höckerschildkröte (Graptemys flavimaculata) Cagle, 1954 - Teil 1. Testudina, 1, 13–16.
Selman, W. & C. P. Qualls (2008a). Graptemys flavimaculata (yellow-blotched map turtle). Foraging behavior. Herpetological Review, 39(2), 215.
Selman, W. & C. P. Qualls (2008b). Graptemys flavimaculata (yellow-blotched Map Turtle). Interspecific basking sitecompetition. Herpetological Review 39:214–215.
Selman, W. & C. P. Qualls (2008c). The impacts of Hurricane Katrina on a population of yellow-blotched sawback (Graptemys flavimaculata) in the lower Pascagoula River. Herpetological Conservation and Biology, 3(2), 224–230.
Selman, W. & C. P. Qualls (2009). Distribution and abundance of two imperiled Graptemys species of the Pascagoula River system. Herpetological Conservation and Biology 4:171–184.
Selman, W., D. Strong & C. P. Qualls (2009). Graptemys flavimaculata (yellow-blotched sawback). Unusual basking disturbance. Herpetological Review, 40(1), 78.
Selman, W. (2010). Conservation and ecology of the yellow-blotched sawback (Graptemys flavimaculata). Ph.D. Thesis , University of Southern Mississippi, Hattiesburg, MS.
Selman, W. (2011). Graptemys flavimaculata (yellow-blotched sawback). Unique aerial basking behaviors. Herpetological Review, 42(4), 593–595.
Selman, W. & C. P. Qualls (2011). Basking ecology of the yellow-blotched sawback (Graptemys flavimaculata), an imperiled turtle species of the Pascagoula River system, Mississippi, USA. Chelonian Conservation and Biology 10:187–197.
Selman, W. & R. L. Jones (2011). Graptemys flavimaculata Cagle 1954—yellow-blotched sawback, yellow-blotched map turtle. Pages 052.1–052.11 in A. G. J. Rhodin, P. C. H. Pritchard, P. P. van Dijk, R. A. Saumure, K. A. Buhlmann, J. B. Iverson & R. A. Mittermeier, editors. Conservation biology of freshwater turtles and tortoises: a compilation project of the IUCN/SSC Tortoise and Freshwater Turtle Specialist Group. Chelonian Research Monographs No. 5.
Selman, W. (2012). Intradrainage variation in population structure, shape morphology, and sexual size dimorphism in the yellow-blotched sawback, Graptemys flavimaculata. Herpetological Conservation and Biology 7(3):427–432.
Selman, W., C. P. Qualls & J. Owen (2013a). Effects of human disturbance on the behavior and physiology of an imperiled freshwater turtle. Journal of Wildlife Management 77:877–885.
Selman, W., B. Kreiser & C. P. Qualls (2013b). Conservation genetics of the yellow-blotched sawback (Emydidae: Graptemys flavimaculata). Conservation Genetics 14:1193–1203.
Shelby, J. A., M. T. Mendonca, B. H. Horne & R. A. Seigel (2000). Seasonal variation in reproductive steroids of male and female yellow-blotched map turtles, Graptemys flavimaculata. General and Comparative Endocrinology 119:43–51.
Shelby, J. A. & M. T. Mendonca (2001). Comparison of reproductive parameters in male yellow-blotched map turtles (Graptemys flavimaculata) from a historically contaminated site and a reference site. Comparative Biochemistry and Physiology Part C 129:233–242.
Shelby-Walker, J. A., C. K. Ward & M. T. Mendonca (2009). Reproductive parameters in female yellow-blotched map turtles (Graptemys flavimaculata) from a historically contaminated site versus a reference site. Comparative Biochemistry and Physiology - Part A: Molecular & Integrative Physiology, 154(3), 401–408.
Steinauer, M. L. & B. D. Horne (2002). Enteric helminths of Graptemys flavimaculata Cagle, 1954, a threatened chelonian species from the Pascagoula River in Mississippi, U.S.A. Comparative Parasitology, 69(2), 219–222.
Stephens, P. R. & J. J. Wiens (2003). Ecological diversification and phylogeny of emydid turtles. Biological Journal of the Linnaean Society 79:577–610.
Stewart, J. H. (1990). Endangered and threatened wildlife and plants; proposed threatened status for the yellow-blotched map turtle Graptemys flavimaculata. Federal Register 55:28570–28573
van Dijk, P.P. (2013). Graptemys flavimaculata. The IUCN Red List of Threatened Species. Version 2014.3. <www.iucnredlist.org>. Abgerufen am 29 Dezember 2014.
White, G. C. (1996). NOREMARK: Population estimation from mark-resighting surveys. Wildlife Society Bulletin 24:50–52.
Wiens, J. J., C. A. Kuczynski & P. R. Stephens (2010). Discordant mitochondrial and nuclear gene phylogenies in emydid turtles: implications for speciation and conservation. Biological Journal of the Linnaean Society 99:445–461.
Internetquellen:
IUCN/SSC Tortoise and Freshwater Turtle Specialist Group/Turtles in Trouble
www.iucn-tftsg.org/trouble abgerufen am 8. 11. 2015
Mississippi Department of Wildlife, Fisheries, & Parks
www.mdwfp.com abgerufen am 5. 2. 2015
USGS – The Pascagoula River Basin
http://ms.water.usgs.gov/ms_proj/eric/pasca.html abgerufen am 26. 2. 2015